さてきょうは大晦日で、仕事納めがない人も自動的に仕事納め(明日は仕事始め)になる。それで、腎臓内科の身内を勇気づけるこんな論文(JAMA Netw Open 2018 1 e184852)で2018年を締めくくろうと思う。
「腎臓内科外来は、すべての専門内科のなかで最も大変!」という論文だ。
これはカナダ・アルバータ州の外来患者データを科ごとに解析し、併存疾患数・精神疾患・処方・救急搬送・入院・入施設・死亡など9つの観点(さらに、社会経済的な面も加味)から複雑さの度合いを出して比べたものだ。
それによれば、科ごとの複雑さは次のような順番になった。
1. 腎臓内科
2. 感染症科
3. 神経内科
4. 呼吸器内科
5. 血液内科
6. リウマチ内科
7. 消化器内科
8. 循環器内科
9. 総合内科
10. 内分泌内科
11. アレルギー・免疫科
12. 皮膚科
13. 家庭医療科
論文著者は、「どの科がどうかより、科ごとに違いがあると知るのが大事」といい、「それを支払いに反映させたらどうなるか」などの議論を提案している(政治的だが、元来支払いは手技に重きが置かれてきた、こちらも参照)。
私たちは、どうすればいいか?私は不意に持ち上げられて戸惑った(個人的には、もっと大変だろうなと思う科がたくさんある)。根治療法が限られたり処方する薬の数が多かったり患者さんに申し訳ない思いもある。
それでも、「ありがとう、来年もまたがんばります!」といい気分でよい年を迎えさせてくれる論文ではないか。
そんなわけで、来年もよろしくお願いします。
(このブログが2007年11月にはじまってから、11年が経ちました。12年目も引き続きよろしくお願い申し上げます!)
クマさんがおしっこしないで冬眠できるのも、じん臓が一日に体液の何十倍もろ過してから不要なものを残して再吸収するのも、じん臓の替わりをしてくれる治療があるのも、すごいことです。でも一番のキセキは、こうして腎臓内科をつうじてみなさまとお会いできたこと。その感謝の気持ちをもって、日々の学びを共有できればと思います。投稿・追記など、Xアカウント(@Kiseki_jinzo)でもアナウンスしています。
2018/12/31
2018/12/18
事実は小説よりも奇なり
たまには腎臓以外の臓器にも思いを馳せてみる。
NEJM pictureシリーズ とても面白く興味深いものを提示されることが多い。今回もよくある心不全患者の治療中という状況のはずだったが、、、
話題となったのはこの記事。
慢性心不全の急性増悪で入院した36歳の男性で既往にEF20%の心不全、A弁術後、大動脈瘤に関して血管内治療後、完全房室ブロックに対してペースメーカー留置されている。
呼吸不全の管理のために補助人工心臓とヘパリンを使用していた。咳をしていたところ患者さんの口から噴出したものが下記のもの。
こんなの見たことない。事実の前には自分の常識は通用しない。
"Truth is stranger than fiction. " Lord Byron / George Gordon Byron, 1788-1824
2018/12/15
高ナトリウム血症:Adipsic Hypernatremiaに関して
以前に低ナトリウム血症の投稿でも話したように、低ナトリウム血症も高ナトリウム血症も基本的には水(自由水)の異常である。水に比べ相対的にNaが多くなれば高ナトリウム血症となる。
高ナトリウム血症の原因は、下記のようなイラストにもあるように、過剰なNaの摂取(基本的には人は浸透圧変化→ADH作用→口渇し飲水で高ナトリウムを起こさないが、集中治療室などで飲水できない場合などでメイロンの投与などで起こりうる)浸透圧利尿を生じるマンニトールなどの使用、尿崩症、下痢などでの自由水の喪失、口渇があるのに全く自由水を摂取しないなどが原因としてあげられる。
(※ADH:Anti-Diuretic Hormone 抗利尿ホルモン)
高ナトリウム血症の原因は、下記のようなイラストにもあるように、過剰なNaの摂取(基本的には人は浸透圧変化→ADH作用→口渇し飲水で高ナトリウムを起こさないが、集中治療室などで飲水できない場合などでメイロンの投与などで起こりうる)浸透圧利尿を生じるマンニトールなどの使用、尿崩症、下痢などでの自由水の喪失、口渇があるのに全く自由水を摂取しないなどが原因としてあげられる。
(※ADH:Anti-Diuretic Hormone 抗利尿ホルモン)
今回、Adipsic Hypernatremiaについて話そうと思う。
この言葉は、あまり耳慣れない人も多いのではないだろうか?
人体は口渇により水を飲み、高ナトリウム血症にならないように働く。その重要なキーマンが下垂体後葉から出るADHである。
厳密には、ADHは口渇だけでなく尿Na量も変化させ排尿量も調整を行なっている。
Adipsic Hypernatremiaは日本語では無飲性高ナトリウム血症と言われるように、口渇感がない高ナトリウム血症である。
原因として、口渇が働かなくなる中枢性のものを鑑別にあげる必要がある。
頭蓋咽頭腫、中枢性サルコイドーシス、胚細胞腫、Willis動脈輪の前交通動脈へのClippingや破裂などがあげられる。
Adipsic HyponatremiaにはtypeがありTypeA〜Dまで分かれる。
TypeAはもっとも多いTypeで、口渇を感じることとADHを分泌する上行性の閾値が高くなり、口渇が感じずADHも出ず高ナトリウム血症になるものである。
しかし、原因自体は明確にわかってはいなく浸透圧受容器の障害では?などの議論がある。
TypeBはADHが出てはいるが少量しか出ないものである。原因は浸透圧受容器の一部がなくなることによって起こると言われる。
TypeCは全くADHが出ないことによる。原因はTypeBと異なり、全ての浸透圧受容器がなくなったためによる。
TypeDは診断されることも少なく特に稀である。ADH分泌は保たれているが口渇だけないものである。
もちろん治療はしっかりと水を飲ませることである。
口渇がないが、しっかりと水を飲むことの重要性を認識させる。また、原因疾患となるようなものがないかはチェックすることは重要である。
DDAVPも使用し良好といった報告もあるが、しっかりと自由水摂取させることは忘れてはならない。
※DDAVP:デスモプレシン
この診断をつけるために大事なことは、高ナトリウム血症の患者さんが目の前にいた時に「喉は乾いてますか??」と聞くのが一番大事である!!
「全然乾いてないですよ。」というようであれば、この疾患を想起してほしい。
2018/12/12
間質性腎炎のステロイド投与期間
ここ最近で間質性腎炎の腎生検での報告件数は増えていることはご存知であろうか?
この論文(QJM2015)はスコットランドの報告ではあるが、割合が増加していることが示されている。
また、報告によっては急性腎障害の原因のTop3に間質性腎炎が入っているのではないかとも言われている。
最近は免疫チェックポイント阻害薬のぺムロリズマブやニボルマブによる間質性腎炎の報告も多くなっており、Hot Topicなのではないだろうか?
薬剤性間質性腎炎の際に、治療として薬剤の中止が原則となる。薬剤中止により腎機能が改善する場合も多いが、全く改善しないまま透析や軽度改善したがCKDに移行するということも少なくない(NDT2004)。
薬剤中止以外の治療オプションとしてステロイドを使用する場面も非常に多いと思う。
ただ、薬剤性間質性腎炎においてのステロイド投与の効果は前向き研究などでの証明もされていないが、コホート研究では間質性腎炎の診断後早期に使用したほうがいい結果が出たという報告がある(KI 2008)。
今回、下記の図のようにretrospectiveな研究ではあるが、薬剤性急性間質腎炎における投与期間について述べている論文があったので紹介する。
スペインの13施設で182人の薬剤性急性間質性腎炎(腎生検で証明されたもの)で、ステロイド投与をおこなった研究である。ステロイド投与量に関しては、平均は0.8±0.2mg/kg/dayで開始している(ちなみにUp to dateの記載では、下記のようになっている)。
この研究では、6ヶ月後の腎機能のフォローを行い腎機能の変化を見ている。
間質性腎炎の原因薬剤に関しては、この研究ではNSAIDsが27%、抗生物質が22%、PPIが4%、薬剤の原因が不明が30%となっている。
研究の結果は、完全に改善(41%)も部分的に改善(46%)、改善しない(13%、そのうち半数は維持透析に移行)であった。
改善と改善しないものに関しての違いとして、ステロイドの早期投与と腎生検組織の繊維化(>50%以上)の程度が関連していた。
この研究では、
・腎生検時期から急性間質性腎炎の診断の平均期間は11日(5.75~22 days)であった。これは、日本でも外注の場合に依頼し結果を得るまでにはそのくらいの期間になる。
・治療開始後に腎機能の変化は1ヶ月での反応が重要である。1ヶ月目以降の変化はどの場合でも乏しい(下表参照)。
・投与期間に関してはステロイド開始し3週間以上は高容量で投与しても効果乏しく、またそこから減量していくのも5~6週以上を要しても意味がないことが示された。
つまり、薬剤性急性間質性腎炎の際は
・まずは原因薬剤の中止。
・その後、早期治療!生検を行なった場合には繊維化はどうかはチェック。
・0.8~1mg/kg/dayのステロイド投与を開始。最高でも3週間。
・徐々に減量していき、5~6週以内にはOFFにする。
ということが今回の報告からは言われている。
今後、これについても色々とエビデンスが構築されればなと思う。
また、Twitterでもご意見をいただければ幸いです。
https://twitter.com/Kiseki_jinzo
この論文(QJM2015)はスコットランドの報告ではあるが、割合が増加していることが示されている。
また、報告によっては急性腎障害の原因のTop3に間質性腎炎が入っているのではないかとも言われている。
最近は免疫チェックポイント阻害薬のぺムロリズマブやニボルマブによる間質性腎炎の報告も多くなっており、Hot Topicなのではないだろうか?
薬剤性間質性腎炎の際に、治療として薬剤の中止が原則となる。薬剤中止により腎機能が改善する場合も多いが、全く改善しないまま透析や軽度改善したがCKDに移行するということも少なくない(NDT2004)。
薬剤中止以外の治療オプションとしてステロイドを使用する場面も非常に多いと思う。
ただ、薬剤性間質性腎炎においてのステロイド投与の効果は前向き研究などでの証明もされていないが、コホート研究では間質性腎炎の診断後早期に使用したほうがいい結果が出たという報告がある(KI 2008)。
今回、下記の図のようにretrospectiveな研究ではあるが、薬剤性急性間質腎炎における投与期間について述べている論文があったので紹介する。
 |
| CJASN 2018より引用 |
スペインの13施設で182人の薬剤性急性間質性腎炎(腎生検で証明されたもの)で、ステロイド投与をおこなった研究である。ステロイド投与量に関しては、平均は0.8±0.2mg/kg/dayで開始している(ちなみにUp to dateの記載では、下記のようになっている)。
One possible regimen is prednisone at a dose of 1 mg/kg per day (to a maximum of 40 to 60 mg) for a minimum of one to two weeks)
この研究では、6ヶ月後の腎機能のフォローを行い腎機能の変化を見ている。
間質性腎炎の原因薬剤に関しては、この研究ではNSAIDsが27%、抗生物質が22%、PPIが4%、薬剤の原因が不明が30%となっている。
研究の結果は、完全に改善(41%)も部分的に改善(46%)、改善しない(13%、そのうち半数は維持透析に移行)であった。
改善と改善しないものに関しての違いとして、ステロイドの早期投与と腎生検組織の繊維化(>50%以上)の程度が関連していた。
この研究では、
・腎生検時期から急性間質性腎炎の診断の平均期間は11日(5.75~22 days)であった。これは、日本でも外注の場合に依頼し結果を得るまでにはそのくらいの期間になる。
・治療開始後に腎機能の変化は1ヶ月での反応が重要である。1ヶ月目以降の変化はどの場合でも乏しい(下表参照)。
・投与期間に関してはステロイド開始し3週間以上は高容量で投与しても効果乏しく、またそこから減量していくのも5~6週以上を要しても意味がないことが示された。
つまり、薬剤性急性間質性腎炎の際は
・まずは原因薬剤の中止。
・その後、早期治療!生検を行なった場合には繊維化はどうかはチェック。
・0.8~1mg/kg/dayのステロイド投与を開始。最高でも3週間。
・徐々に減量していき、5~6週以内にはOFFにする。
ということが今回の報告からは言われている。
今後、これについても色々とエビデンスが構築されればなと思う。
また、Twitterでもご意見をいただければ幸いです。
https://twitter.com/Kiseki_jinzo
2018/12/06
PIVOTAL 前編
62歳男性、81kg。糖尿病性腎症による末期腎不全のため血液透析をはじめて、4.9年。ヘモグロビン10.6g/dl、EPO32000単位/月(ネスプ®約40mcg/週相当)、フェリチン214mcg/l、TSAT20%。鉄補充はうけていない。
Q:何か問題ありますか?
日本のガイドライン(透析会誌 2016 49 89)は、ESA投与下でHgbが維持できない患者であっても、「フェリチン100未満」と「TSAT20%未満」のどちらも満たさなければ鉄補充療法は推奨していない(1B)。
これより緩和された、「フェリチン100未満」と「TSAT20%未満」のどちらかがあれば鉄補充を提案する(ただし鉄利用障害を除く)、というステートメント3.2もある。しかし、これはなんと「作成ワーキンググループ会議にて全会一致ではなく 2/3 以上の合意をもって採択された唯一の記載」だ。
それくらい、ひとことで言うと(高ESAの害よりも)鉄過剰の害を嫌う。鉄の害とは感染症、酸化ストレス、沈着による臓器障害(要はヘモクロマトーシスのような)、などのことだ。
それで、鉄含有リン吸着薬も「リンが減って鉄も補充できて一石二鳥!」とはならない(残念ながら鉄が少しは吸収されてしまいます・・・という売り方になる)。「補充時にフェリチンが 300を越えないように」という閾値も、世界で最も厳しい。極論すると、フェリチンが一桁でも、現場は意外とこれはまずい!ということにならない(慢性的な消化管出血の除外などは考慮するにしてもだ)。
では実際のところ、鉄の害(以前学会ではこんな話もあった)と高ESAの害ではどちらが悪いか?という話は、日本だけでなく世界各国でされている。それで、実際に鉄補充によるESA反応性改善のメリットと、鉄過剰のデメリットをくらべたPIVOTALスタディが英国で組まれた(DOI: 10.1056/NEJMoa1810742、2018年米国腎臓学会でも注目された)。
冒頭の患者は本スタディの平均的な症例だ。この試験にはフェリチン400未満、TSAT30%未満でESA使用中の血液透析患者が登録された。
なお、4割が透析カテーテルで、6割が内シャントまたは人工血管で透析されていた。
平均2.1年のフォロー中、毎月フェリチンとTSATを測り、高用量群では400mg/月のスクロース鉄をフェリチン700、TSAT40%を越えないように打った(Vifor Pharma社のVenofer®を、同社が無償提供)。
実際の投与量は264mg/月で、フェリチンは650、TSATは28%となった。264mg/月と400より低いのは、最初の数ヶ月で鉄が一気に満たされ、以後は打たなくてよくなったからでもある(下図青線、縦軸はフェリチン)。
いっぽう低用量群では毎月0-400mgのスクロース鉄をフェリチン200以上、TSAT20%以上を保つように加減して投与した。そして実際の投与量は121mg/月で、フェリチンは200、TSATは20-22%であった。
それでどうなったか?つづく(写真の新型スーパーあずさを鑑賞するのは、別の「鉄」分補給。いつかできるかもしれないリニア中央新幹線よりずっと遅いが、車窓はなかなか)。
Q:何か問題ありますか?
日本のガイドライン(透析会誌 2016 49 89)は、ESA投与下でHgbが維持できない患者であっても、「フェリチン100未満」と「TSAT20%未満」のどちらも満たさなければ鉄補充療法は推奨していない(1B)。
これより緩和された、「フェリチン100未満」と「TSAT20%未満」のどちらかがあれば鉄補充を提案する(ただし鉄利用障害を除く)、というステートメント3.2もある。しかし、これはなんと「作成ワーキンググループ会議にて全会一致ではなく 2/3 以上の合意をもって採択された唯一の記載」だ。
それくらい、ひとことで言うと(高ESAの害よりも)鉄過剰の害を嫌う。鉄の害とは感染症、酸化ストレス、沈着による臓器障害(要はヘモクロマトーシスのような)、などのことだ。
それで、鉄含有リン吸着薬も「リンが減って鉄も補充できて一石二鳥!」とはならない(残念ながら鉄が少しは吸収されてしまいます・・・という売り方になる)。「補充時にフェリチンが 300を越えないように」という閾値も、世界で最も厳しい。極論すると、フェリチンが一桁でも、現場は意外とこれはまずい!ということにならない(慢性的な消化管出血の除外などは考慮するにしてもだ)。
では実際のところ、鉄の害(以前学会ではこんな話もあった)と高ESAの害ではどちらが悪いか?という話は、日本だけでなく世界各国でされている。それで、実際に鉄補充によるESA反応性改善のメリットと、鉄過剰のデメリットをくらべたPIVOTALスタディが英国で組まれた(DOI: 10.1056/NEJMoa1810742、2018年米国腎臓学会でも注目された)。
冒頭の患者は本スタディの平均的な症例だ。この試験にはフェリチン400未満、TSAT30%未満でESA使用中の血液透析患者が登録された。
なお、4割が透析カテーテルで、6割が内シャントまたは人工血管で透析されていた。
平均2.1年のフォロー中、毎月フェリチンとTSATを測り、高用量群では400mg/月のスクロース鉄をフェリチン700、TSAT40%を越えないように打った(Vifor Pharma社のVenofer®を、同社が無償提供)。
実際の投与量は264mg/月で、フェリチンは650、TSATは28%となった。264mg/月と400より低いのは、最初の数ヶ月で鉄が一気に満たされ、以後は打たなくてよくなったからでもある(下図青線、縦軸はフェリチン)。
いっぽう低用量群では毎月0-400mgのスクロース鉄をフェリチン200以上、TSAT20%以上を保つように加減して投与した。そして実際の投与量は121mg/月で、フェリチンは200、TSATは20-22%であった。
それでどうなったか?つづく(写真の新型スーパーあずさを鑑賞するのは、別の「鉄」分補給。いつかできるかもしれないリニア中央新幹線よりずっと遅いが、車窓はなかなか)。
2018/12/02
Na摂取が高血圧の要因になる!なんで??
投稿の日は僕の大好きな電解質セミナーが開かれている日なので、今日は電解質に関しての投稿にしようかなと思います(ほぼ電解質ではないですが。。)。
高血圧単独で亡くなることは少ないが、高血圧は心血管疾患の最大危険因子であり、脳卒中・心血管死亡の半数以上が高血圧に関連すると言われている。
特に、この塩分摂取に伴う高血圧は日本人では起こりやすいと言われている。
以前は
塩分摂取過剰→腎臓からの尿中へのNa+排泄が追いつかず体液中Na+上昇→血液浸透圧の上昇→血管内に浸透圧勾配で水の流入→血液量が増加し高血圧
全身の血管の交感神経の活性化→血管収縮→高血圧を発症
この最近の説は降圧薬の機序を考えてもCa拮抗薬などは血管拡張作用があり、理にはかなっている。
・Nax:
ナトリウムチャネルの一つで細胞外ナトリウム濃度の上昇に応じて開口し細胞内にナトリウムを流入させる機能を持つ。
脳内器官の一つで交感神経や血圧の制御に関与。
脳内器官の一つで同様に交感神経や血圧の制御に関与。
細胞外のpH低下に反応して開口する陽イオンチャンネル
→Naxが脳内センサーとして関連しているとわかった。
→結論として、OVLTのグリア細胞に発現するNaxが活性化しH+が放出され、ASIC1を開始OVLTニューロンを活性化し交感神経上昇し血圧上昇に関連していることがわかった。また、OVLT→PVN→RVLM(頭側延髄外側野)→脊髄でも同様に交感神経活性化することがわかった(上図参照)。
交感神経のブロック薬や新規の薬が高血圧治療に出てくる可能性がある。
是非、Twitterもフォローしてください!
https://twitter.com/Kiseki_jinzo
まず、高血圧は成人の中で4300万人が罹患しているとされている(本邦で)。
高血圧単独で亡くなることは少ないが、高血圧は心血管疾患の最大危険因子であり、脳卒中・心血管死亡の半数以上が高血圧に関連すると言われている。
高血圧の原因でよく言われるのが塩分摂取過剰である。
特に、この塩分摂取に伴う高血圧は日本人では起こりやすいと言われている。
この原因としては
以前は
塩分摂取過剰→腎臓からの尿中へのNa+排泄が追いつかず体液中Na+上昇→血液浸透圧の上昇→血管内に浸透圧勾配で水の流入→血液量が増加し高血圧
最近は
全身の血管の交感神経の活性化→血管収縮→高血圧を発症
という説が有力になっている。
この最近の説は降圧薬の機序を考えてもCa拮抗薬などは血管拡張作用があり、理にはかなっている。
ただ、交感神経活性化はどこで感知しているのか??というのが今まで未解明であった。
体内のNa濃度上昇→??→交感神経活性化
今回日本人のグループがこれを解明して論文に報告されていたので簡潔に記載しようと思う。ぜひ、論文を読んでくださいね。
まず、キーワードは
・Nax:
ナトリウムチャネルの一つで細胞外ナトリウム濃度の上昇に応じて開口し細胞内にナトリウムを流入させる機能を持つ。
・OVLT(終板脈管器官):
脳内器官の一つで交感神経や血圧の制御に関与。
・PVN(視床下部傍核):
脳内器官の一つで同様に交感神経や血圧の制御に関与。
・ASIC1(酸感受性イオンチャンネル1):
細胞外のpH低下に反応して開口する陽イオンチャンネル
わかりやすい図として、今回の論文のキーになるものを下図に示す。
もともとこのグループは細胞外液Na+濃度上昇に応じて開口するNaxを見出していた。
その後、Nax欠損マウスでは脳脊髄液のNa+濃度を上昇させても交感神経活性化や血圧上昇は起こらなかった。
→Naxが脳内センサーとして関連しているとわかった。
では、どの領域で起こっているのかと言うことを次に調べた。
→結論として、OVLTのグリア細胞に発現するNaxが活性化しH+が放出され、ASIC1を開始OVLTニューロンを活性化し交感神経上昇し血圧上昇に関連していることがわかった。また、OVLT→PVN→RVLM(頭側延髄外側野)→脊髄でも同様に交感神経活性化することがわかった(上図参照)。
今後ここから発展することとしては、降圧薬開発なのではないか?
交感神経のブロック薬や新規の薬が高血圧治療に出てくる可能性がある。
是非、Twitterもフォローしてください!
https://twitter.com/Kiseki_jinzo
2018/11/30
ACE inhibitorが癌の増加に寄与??
高血圧患者の割合は多く、高血圧に対して降圧薬の内服をしている人も非常に多い。
また、高血圧の基準に関しては近年変遷が大きい。これに関しては以前に書いている。
日本でも2019年度に高血圧治療ガイドラインも刊行が予定されている。
高血圧の基準値に関しては、現在、ACC(米国心臓協会)の高血圧ガイドラインでは、130/80mmHgに引き下げられている。
本邦では現時点では、高血圧基準を140/90mmHgとし合併症がない75歳未満の降圧目標を130/80mmHg未満に引き下げる方向となっている。これは、最新の本邦のガイドラインが刊行されてみないとわからない。
その降圧目標を達成するために、降圧薬もいろいろな種類が使用されている。
下図はNDB(レセプト情報・特定健診等情報データベース)のデータである。
割合としては、ARBが多いが、タナトリルやレニベースなどのACE阻害薬(ACE-I)も処方としては多い。
今回は、このACE-Iが癌の増加に寄与しているのでは?という報告があったのでみてみよう。
この報告の前までは、メタアナリシスではARBの使用やACE-Iの使用で全般的な癌関連死の増加との関連はないことが示されていた(LANCET oncol 2011)。
今回の報告は、英国の100万人近いデータのコホート研究でACE-IかARB使用で、癌、特に肺癌との関連はどうなのか?というのを見ている(BMJ 2018)。
細かい部分は論文を読んでいただきたいが、結論としてはACE-Iでは肺癌の発生率が増加し、また内服期間が延長すればするほど肺癌の発生率が上昇するといったものであった。
これだけ聞いてしまうと、ACE-Iは肺癌の可能性が上がるから使用しない方がいいのか?と思ってしまう。
この論文に関しては、早速Rapid responseが寄せられており、ACE-Iの肺癌リスクは少ないと言っている。もちろん肺癌の最大リスクは喫煙である。
この報告で注意すべきこととしては、交絡や発見バイアスなどが含まれていることである。この場合の発見バイアスは
が考えられる。
この結果は、もちろん交絡因子の除外やバイアスの除外の点などからも前向き研究での検討が待たれる。
ACE-IはARBに比してコストパフォーマンスはいい。コストの面、リスクの面色々な面を見て患者に適応していければいいと思う。
是非、Twitterもフォローしてください!
https://twitter.com/Kiseki_jinzo
また、高血圧の基準に関しては近年変遷が大きい。これに関しては以前に書いている。
日本でも2019年度に高血圧治療ガイドラインも刊行が予定されている。
高血圧の基準値に関しては、現在、ACC(米国心臓協会)の高血圧ガイドラインでは、130/80mmHgに引き下げられている。
本邦では現時点では、高血圧基準を140/90mmHgとし合併症がない75歳未満の降圧目標を130/80mmHg未満に引き下げる方向となっている。これは、最新の本邦のガイドラインが刊行されてみないとわからない。
その降圧目標を達成するために、降圧薬もいろいろな種類が使用されている。
下図はNDB(レセプト情報・特定健診等情報データベース)のデータである。
割合としては、ARBが多いが、タナトリルやレニベースなどのACE阻害薬(ACE-I)も処方としては多い。
今回は、このACE-Iが癌の増加に寄与しているのでは?という報告があったのでみてみよう。
この報告の前までは、メタアナリシスではARBの使用やACE-Iの使用で全般的な癌関連死の増加との関連はないことが示されていた(LANCET oncol 2011)。
今回の報告は、英国の100万人近いデータのコホート研究でACE-IかARB使用で、癌、特に肺癌との関連はどうなのか?というのを見ている(BMJ 2018)。
細かい部分は論文を読んでいただきたいが、結論としてはACE-Iでは肺癌の発生率が増加し、また内服期間が延長すればするほど肺癌の発生率が上昇するといったものであった。
これだけ聞いてしまうと、ACE-Iは肺癌の可能性が上がるから使用しない方がいいのか?と思ってしまう。
この論文に関しては、早速Rapid responseが寄せられており、ACE-Iの肺癌リスクは少ないと言っている。もちろん肺癌の最大リスクは喫煙である。
この報告で注意すべきこととしては、交絡や発見バイアスなどが含まれていることである。この場合の発見バイアスは
ACE-Iの使用 → 副作用の咳嗽 → 咳嗽の検査のために肺のレントゲン検査 →肺癌の発見率上昇
が考えられる。
この結果は、もちろん交絡因子の除外やバイアスの除外の点などからも前向き研究での検討が待たれる。
ACE-IはARBに比してコストパフォーマンスはいい。コストの面、リスクの面色々な面を見て患者に適応していければいいと思う。
是非、Twitterもフォローしてください!
https://twitter.com/Kiseki_jinzo
2018/11/29
「じん」をめぐる冒険
このところ、投稿の最後にTwitterのことが書いてあるので、もうサイト(https://twitter.com/Kiseki_jinzo)に行ってくださった方もいらっしゃるかも知れない。そして、下図のプロフィール写真にも目を留めてくださったかもしれない。
これはもちろん、「今年の漢字」のパロディだ。いつかはこんな日が・・と、私はずっと「キセキ」に期待している。腎臓病の治癒ができたら、あるいは、新しい人工腎臓ができたら、叶うかな。しかし今年の応募期間は12月5日までだから、まだ「腎」にもチャンスはある。12月12日の京都・清水寺での発表が待ち遠しい。
そんなわけで、きょうはこの「腎」という言葉について考えてみたい。まずは、空港でのこんな会話スキットに注目してみよう。
入国審査官「あなたは何をしていますか?」
私「医師です」
入国審査官「専門は?」
私「Nephrologistです」
入国審査官「え、何?」
腎臓内科・腎臓病・腎不全は日本語ではすべて「腎」だが、英語だとそれぞれネフロ(nephro)・キドニー(kidney)・リーナル(renal) と異なる。そしてネフロはギリシャ語、リーナルはラテン語だから、一般には通じにくい(リーナルは、フランス・スペインなどのラテン語圏なら通じるかもしれないが)。
それで、さきほどのスキットでは「キドニー・ドクターです」と言ったほうが通じやすい。中期英語でよりアングロサクソンな「キドニー」は、豆の名前にもなるくらい誰でも知っているからだ。CRF(chronic renal failure)をCKD(chronic kidney disease)にした米国腎臓財団タスクフォースK/DOQIの2002年宣言にも、名称変更の理由にその旨が明記されている。
つぎに、「腎」という漢字についてはどうか。左上の臣は「目を見開いた」、転じて「従う・家来」の意味があり、右上の又は「手」の意味がある。そしてこの二つが合わさると、「かたい・しっかりした」という意味になるそうだ。神のしもべの瞳を傷つけ身体を硬くする、家臣がひざまずいて身体を固くするなど諸説ある。
だから「腎」は、「かたい・しっかりした臓器」ということだ。たしかに、かたい。そして、しっかりしている。余談だが「腎」の「にくづき」を「貝」にした「賢」も同様に、「しっかりした通貨・宝を持っている」から「かしこい」の意味になったという。
ここまできたから、韓国語と和語についても触れておく。韓国語では、「腎臓」のハングル読み신장(シンジャン)も用いるが、より一般に使うのは콩팥(コンパッ)で、콩は「まめ」、팥は「あずき」だ(あずきカキ氷として日本でもお馴染みなパッピンスの「パッ」)。
そして和語は、「むらと」だ。平安中期に編纂された辞書「倭名類聚抄(わみょうるいじゅしょう)」に記載があるらしい。おそらく、身体の各部について説明した形體部だろう。解釈によれば「むら」は「まわる」、「と」は「ところ」に通じ、あわせて「循環するところ」という意味だそうだ。
循環する臓器はたくさんあるが、腎臓を「むらと」と名づけた先祖はすごい。
話はめぐってめぐりますが、最初のとおり、Twitterともども今後ともよろしくお願い申し上げます。
https://twitter.com/Kiseki_jinzo
これはもちろん、「今年の漢字」のパロディだ。いつかはこんな日が・・と、私はずっと「キセキ」に期待している。腎臓病の治癒ができたら、あるいは、新しい人工腎臓ができたら、叶うかな。しかし今年の応募期間は12月5日までだから、まだ「腎」にもチャンスはある。12月12日の京都・清水寺での発表が待ち遠しい。
そんなわけで、きょうはこの「腎」という言葉について考えてみたい。まずは、空港でのこんな会話スキットに注目してみよう。
入国審査官「あなたは何をしていますか?」
私「医師です」
入国審査官「専門は?」
私「Nephrologistです」
入国審査官「え、何?」
腎臓内科・腎臓病・腎不全は日本語ではすべて「腎」だが、英語だとそれぞれネフロ(nephro)・キドニー(kidney)・リーナル(renal) と異なる。そしてネフロはギリシャ語、リーナルはラテン語だから、一般には通じにくい(リーナルは、フランス・スペインなどのラテン語圏なら通じるかもしれないが)。
それで、さきほどのスキットでは「キドニー・ドクターです」と言ったほうが通じやすい。中期英語でよりアングロサクソンな「キドニー」は、豆の名前にもなるくらい誰でも知っているからだ。CRF(chronic renal failure)をCKD(chronic kidney disease)にした米国腎臓財団タスクフォースK/DOQIの2002年宣言にも、名称変更の理由にその旨が明記されている。
つぎに、「腎」という漢字についてはどうか。左上の臣は「目を見開いた」、転じて「従う・家来」の意味があり、右上の又は「手」の意味がある。そしてこの二つが合わさると、「かたい・しっかりした」という意味になるそうだ。神のしもべの瞳を傷つけ身体を硬くする、家臣がひざまずいて身体を固くするなど諸説ある。
だから「腎」は、「かたい・しっかりした臓器」ということだ。たしかに、かたい。そして、しっかりしている。余談だが「腎」の「にくづき」を「貝」にした「賢」も同様に、「しっかりした通貨・宝を持っている」から「かしこい」の意味になったという。
ここまできたから、韓国語と和語についても触れておく。韓国語では、「腎臓」のハングル読み신장(シンジャン)も用いるが、より一般に使うのは콩팥(コンパッ)で、콩は「まめ」、팥は「あずき」だ(あずきカキ氷として日本でもお馴染みなパッピンスの「パッ」)。
そして和語は、「むらと」だ。平安中期に編纂された辞書「倭名類聚抄(わみょうるいじゅしょう)」に記載があるらしい。おそらく、身体の各部について説明した形體部だろう。解釈によれば「むら」は「まわる」、「と」は「ところ」に通じ、あわせて「循環するところ」という意味だそうだ。
循環する臓器はたくさんあるが、腎臓を「むらと」と名づけた先祖はすごい。
話はめぐってめぐりますが、最初のとおり、Twitterともども今後ともよろしくお願い申し上げます。
https://twitter.com/Kiseki_jinzo
2018/11/28
心臓が悪い人は腎臓も悪いのか??〜後編〜
前回の投稿の続きで
◆この人にとってベストな治療はどうだろうか?について考えてみる。
つまり、HFrEFとCKDを有する人に対しての治療である。
・治療目標:
これは、症状の改善、機能の改善(心臓や腎臓の)、入院回数の減少などの生活の質(QOL)の向上、死亡率の改善であろう。
・治療としては、どんな方法があるのか?
まず、HFrEFの治療として・・・ESC ( European Society of Cardiology)のガイドラインでは、ACE inhibitor、β blockerは耐えうるEBMで確立された最大投与量がFirst Lineの治療となる(下図に日本語のものを添付)。
その後、症状残存しEFが35%以下ならばミネラルコルチコイド阻害薬を投与する。これも耐えうるEBMで確立された最大投与量が推奨されている。
これでも、改善がない場合には本邦での発売は2018年12月現在未ではあるが、イバブラジンやARNI (Angiotensin Receptor Neprilysin inhibitor)を考慮する。
それでも、難しい場合はジゴキシンやH-ISDN (Hydralazine and isosorbide dinitrate)やLVAD (左室補助装置)や心臓移植を考慮する必要がある。
では、CKDが加わった場合にはどうか??
やはり薬がCKDに対してどれだけ影響を与えうるかは考える必要がある。
・ACE inhibitor、ARB
これは我々が最も使用する薬の一つであると同時に悩ましい薬ではないだろうか?少なくとも私にとっては悩ましい薬である。
では、CKDを有する心不全患者に対しての使用はどうであろうか?
まず少し先行研究を振り返る。
– 1987年にNEJMからCONSENSUS Trialが提唱された。
これは、重症心不全に対して従来治療にenalapril(ACE阻害薬)を加えると全死亡はどうなるかを見た研究であるが、この結果でACE阻害薬の有用性が認められた(NYHA分類や心臓サイズの減少)。
この際の腎機能としては平均で血清Cre 1.5mg/dL程度であったが、1.7~3.4mg/dLはハイリスク群として投与量を2.5mg/dayより開始し漸増する方法を用いた(通常は10mg/dayより漸増)。
– 2001年にNEJMからVal-HeFT trialが提唱された。
これは、慢性心不全治療に従来治療にvalsartan(ARB)を追加した場合の死亡率、合併症発生率などを見たものである。
この研究は、ARBを従来治療(ACE-I, β遮断薬, 利尿薬, ジゴキシン)に加えた際に、死亡率や合併症発生は減少したが、ARB+ACE-I+β遮断薬の併用じは死亡率および合併症に有害な結果が出ていることがpost hoc analysisから分かっている。
この研究では、血清Cre >2.5mg/dLは除外されている。
CKD stage4以降の患者対象での研究がほとんどないため、結論づけは難しいがCKD stage3までのHFrEFの患者ではACE-Iの使用は効果を考えると使用はやむを得ないと考える。
・β遮断薬
では、β遮断薬についてはどうであろうか?
これも少し先行研究を振り返る。
–1999年にLANCETからでたMERIT-HF trialをまずは話す。
HFrEFに対してmetoprolol投与で全死亡や全入院の推移を見たものである。
結論としては、死亡率、突然死、入院の低下、NYHA心機能分類の改善に寄与した。
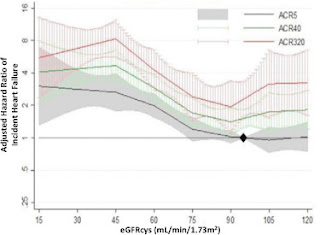
この研究では、腎疾患での除外を行っていなかったためpost hoc analysisで、eGFR<45mL/min/1.73m2の患者群で見た時に、eGFR>60の患者群よりも死亡率の低下に寄与したと報告されている。
なので、進行したCKDでもβ遮断薬の使用は有用である。
これと同様の結果は、高齢者を見たSENIORS trialやCIBIS-Ⅱなどでも示されている。
ただ、すべてのβ遮断薬がいいというわけではなく、アテノロール、ナドロール、ソタロールなどの腎排泄性のものに関しては、高度腎不全の際には使用を控えることが推奨される。
腎臓と心臓に関して少し見ていけたかと思う。
また、もしミネラルコルチコイドについてなどやARNに関して、またACE-Iを途中でや得た場合どうなるのか?などの希望があれば書きたいなとおもう。
もし、希望があれば是非Twitterのフォローとツイートをお願いします。
https://twitter.com/Kiseki_jinzo
◆この人にとってベストな治療はどうだろうか?について考えてみる。
つまり、HFrEFとCKDを有する人に対しての治療である。
・治療目標:
これは、症状の改善、機能の改善(心臓や腎臓の)、入院回数の減少などの生活の質(QOL)の向上、死亡率の改善であろう。
・治療としては、どんな方法があるのか?
まず、HFrEFの治療として・・・ESC ( European Society of Cardiology)のガイドラインでは、ACE inhibitor、β blockerは耐えうるEBMで確立された最大投与量がFirst Lineの治療となる(下図に日本語のものを添付)。
その後、症状残存しEFが35%以下ならばミネラルコルチコイド阻害薬を投与する。これも耐えうるEBMで確立された最大投与量が推奨されている。
これでも、改善がない場合には本邦での発売は2018年12月現在未ではあるが、イバブラジンやARNI (Angiotensin Receptor Neprilysin inhibitor)を考慮する。
それでも、難しい場合はジゴキシンやH-ISDN (Hydralazine and isosorbide dinitrate)やLVAD (左室補助装置)や心臓移植を考慮する必要がある。
やはり薬がCKDに対してどれだけ影響を与えうるかは考える必要がある。
・ACE inhibitor、ARB
これは我々が最も使用する薬の一つであると同時に悩ましい薬ではないだろうか?少なくとも私にとっては悩ましい薬である。
では、CKDを有する心不全患者に対しての使用はどうであろうか?
まず少し先行研究を振り返る。
– 1987年にNEJMからCONSENSUS Trialが提唱された。
これは、重症心不全に対して従来治療にenalapril(ACE阻害薬)を加えると全死亡はどうなるかを見た研究であるが、この結果でACE阻害薬の有用性が認められた(NYHA分類や心臓サイズの減少)。
この際の腎機能としては平均で血清Cre 1.5mg/dL程度であったが、1.7~3.4mg/dLはハイリスク群として投与量を2.5mg/dayより開始し漸増する方法を用いた(通常は10mg/dayより漸増)。
– 2001年にNEJMからVal-HeFT trialが提唱された。
これは、慢性心不全治療に従来治療にvalsartan(ARB)を追加した場合の死亡率、合併症発生率などを見たものである。
この研究は、ARBを従来治療(ACE-I, β遮断薬, 利尿薬, ジゴキシン)に加えた際に、死亡率や合併症発生は減少したが、ARB+ACE-I+β遮断薬の併用じは死亡率および合併症に有害な結果が出ていることがpost hoc analysisから分かっている。
この研究では、血清Cre >2.5mg/dLは除外されている。
CKD stage4以降の患者対象での研究がほとんどないため、結論づけは難しいがCKD stage3までのHFrEFの患者ではACE-Iの使用は効果を考えると使用はやむを得ないと考える。
・β遮断薬
では、β遮断薬についてはどうであろうか?
これも少し先行研究を振り返る。
–1999年にLANCETからでたMERIT-HF trialをまずは話す。
HFrEFに対してmetoprolol投与で全死亡や全入院の推移を見たものである。
結論としては、死亡率、突然死、入院の低下、NYHA心機能分類の改善に寄与した。
この研究では、腎疾患での除外を行っていなかったためpost hoc analysisで、eGFR<45mL/min/1.73m2の患者群で見た時に、eGFR>60の患者群よりも死亡率の低下に寄与したと報告されている。
なので、進行したCKDでもβ遮断薬の使用は有用である。
これと同様の結果は、高齢者を見たSENIORS trialやCIBIS-Ⅱなどでも示されている。
ただ、すべてのβ遮断薬がいいというわけではなく、アテノロール、ナドロール、ソタロールなどの腎排泄性のものに関しては、高度腎不全の際には使用を控えることが推奨される。
腎臓と心臓に関して少し見ていけたかと思う。
また、もしミネラルコルチコイドについてなどやARNに関して、またACE-Iを途中でや得た場合どうなるのか?などの希望があれば書きたいなとおもう。
もし、希望があれば是非Twitterのフォローとツイートをお願いします。
https://twitter.com/Kiseki_jinzo
2018/11/26
どうするDKD
61才女性、糖尿病の既往あり(HgbA1cは7.2%)。かかりつけ医の血液検査で47ml/min/1.73m2のeGFR低下を指摘され、みずから予約して腎臓内科を受診。ARB内服中、アルブミン尿は30mg/日未満。
Q:(潜血・網膜症の有無にかかわらず)腎生検しますか?
上の例は、日本糖尿病学会・日本腎臓学会が2014年に発表した腎症ステージ(下図)のピンク、1期に該当する。両学会はこれを「腎症早期」とも呼んでいるが、これが本当に早期なのかは、議論のあるところだ。
第一に、2期・3期と進行していく(上図で右に向かう)のか分からない。DKDと言う言葉が出てきた時にも紹介したが、1型糖尿病とちがって2型は従来の腎症モデルがあてはまらないかもしれない。蛋白尿が増えずに4・5期に至る(上図で下に向かう)例もあるかもしれない。
あるいは、ずっと1期のままかもしれない。大規模CKDコホートCRICでこの群(正確にはeGFRが20以上なので、上図で1期の真下まで含む)を6年余り追跡したところ、eGFRの低下は年にマイナス0.17ml/min/1.73m2で、末期腎不全に至ったのは5%だった(AJKD 2018 72 653、下図はGFR50%以上低下・末期腎不全をあわせた累積ハザード)。
第二には、「糖尿病患者の蛋白尿のないeGFR低下」は、糖尿病性腎症でないかもしれない。腎硬化症、軽度のIgA腎症なども混じっているかもしれない。
それで、冒頭の「腎生検しますか?」という問いが出てくる。やってもやらなくても予後が変わらないのなら、生検リスクを重く考えて見送る施設が多いかも知れない。しかし、病態解明には生検したほうがいいのかもしれない。尿細管病変中心とか(蛋白尿と尿細管といえば治験薬バルドキソロンも思い出されるが、こちら)、いろいろ情報が得られるかもしれない。
ただでさえ糖尿病性腎症は「やっても治療が変わらない」と腎生検が避けられる傾向にあり、腎病理分類が確立したのもごく最近のことだ(JASN 2010 21 556、糸球体病変の診断フローは下図)。それからも、「8例生検しました」という報告で論文にできるほど(Diabetes Care 2013 36 3620)。
そんなわけで、まだ「糖尿病患者の蛋白尿のないeGFR低下」を表す言葉は、正式に決まっていない。ただ、それを包含する考え方としてDKDが生まれたからには、NP-DKD(non-proteinuric diabetic kidney disease)、NA-DKD(normoalbuminuric diabetic kidney disease)など、DKDに関連した派生語になるかもしれない。
この群を病態解明のために積極的に生検すべきか?腎予後の極めてよい群であり不要なリスクは避けるべきか?
これが「がん」なら、早期癌でも前がん病変でも癌のように見える正常組織でも、比較的迷わず生検されるかもしれない。心血管死や腎不全はがんとは少し違うが、議論のポイントとしては似ている。患者さんもまじえて議論すべき、難しい問題だ。
Q:(潜血・網膜症の有無にかかわらず)腎生検しますか?
上の例は、日本糖尿病学会・日本腎臓学会が2014年に発表した腎症ステージ(下図)のピンク、1期に該当する。両学会はこれを「腎症早期」とも呼んでいるが、これが本当に早期なのかは、議論のあるところだ。
第一に、2期・3期と進行していく(上図で右に向かう)のか分からない。DKDと言う言葉が出てきた時にも紹介したが、1型糖尿病とちがって2型は従来の腎症モデルがあてはまらないかもしれない。蛋白尿が増えずに4・5期に至る(上図で下に向かう)例もあるかもしれない。
あるいは、ずっと1期のままかもしれない。大規模CKDコホートCRICでこの群(正確にはeGFRが20以上なので、上図で1期の真下まで含む)を6年余り追跡したところ、eGFRの低下は年にマイナス0.17ml/min/1.73m2で、末期腎不全に至ったのは5%だった(AJKD 2018 72 653、下図はGFR50%以上低下・末期腎不全をあわせた累積ハザード)。
第二には、「糖尿病患者の蛋白尿のないeGFR低下」は、糖尿病性腎症でないかもしれない。腎硬化症、軽度のIgA腎症なども混じっているかもしれない。
それで、冒頭の「腎生検しますか?」という問いが出てくる。やってもやらなくても予後が変わらないのなら、生検リスクを重く考えて見送る施設が多いかも知れない。しかし、病態解明には生検したほうがいいのかもしれない。尿細管病変中心とか(蛋白尿と尿細管といえば治験薬バルドキソロンも思い出されるが、こちら)、いろいろ情報が得られるかもしれない。
ただでさえ糖尿病性腎症は「やっても治療が変わらない」と腎生検が避けられる傾向にあり、腎病理分類が確立したのもごく最近のことだ(JASN 2010 21 556、糸球体病変の診断フローは下図)。それからも、「8例生検しました」という報告で論文にできるほど(Diabetes Care 2013 36 3620)。
そんなわけで、まだ「糖尿病患者の蛋白尿のないeGFR低下」を表す言葉は、正式に決まっていない。ただ、それを包含する考え方としてDKDが生まれたからには、NP-DKD(non-proteinuric diabetic kidney disease)、NA-DKD(normoalbuminuric diabetic kidney disease)など、DKDに関連した派生語になるかもしれない。
この群を病態解明のために積極的に生検すべきか?腎予後の極めてよい群であり不要なリスクは避けるべきか?
これが「がん」なら、早期癌でも前がん病変でも癌のように見える正常組織でも、比較的迷わず生検されるかもしれない。心血管死や腎不全はがんとは少し違うが、議論のポイントとしては似ている。患者さんもまじえて議論すべき、難しい問題だ。
2018/11/23
シカゴおみやげ
例年春と秋は学会シーズンだが、シカゴはこの時期に多数の学会誘致に成功している(もう寒いにもかかわらず・・私の留学していた夏はこんな感じだが)。本土の真ん中にあってみんなが参加しやすいのかもしれない。
そのひとつがAHA(米国心臓協会)で、私は参加していないがこんなニュースがメールボックスに入ってきた。
Cardiac Remodeling Following Ligation of Arteriovenous Fistula in Stable Renal Transplant Recipients: a Randomised Controlled Study. Abstract 19322
発表は著者がインタビューを受けるくらい(リンク内にYouTube動画あり)だから、かなり注目されたのだろう。
これは、腎移植後1年が経過し、安定したグラフト機能があって、もう透析することはないと見込まれるのなら、「保険」としてシャントを残すメリットよりも、心負荷のデメリットのほうが大きいんじゃないですか?という問いに答えるスタディだ。
約30例ずつのランダム化で結紮群と非結紮群をくらべたところ、6ヵ月後に結紮群で心MRI上左室筋肉量がマイナス11g/m2と有意に減少した。左室筋肉量は心血管死の代理マーカーとして確立しており、これは相当インパクトのある数字だ。ほかにも、左房容積がさがる(心房細動になりにくい)、ANP・BNPなどの心筋ホルモン値の低下などがみられた。
そうはいっても、移植患者さんのシャントを閉じるというのは相当覚悟のいることで、(シャント感染など他の理由がない限り)まずやらない。この発表が大きく取り上げられたのも、そのためである。
移植業界は施設間で診療の差が大きいが、このオーストラリア発のパイロットスタディから、グラフト生着率のよい時代にあわせ移植医療がかわっていくかもしれない(下図は英エコノミスト誌2018年10月27日付のオーストラリア特集号)。
そのひとつがAHA(米国心臓協会)で、私は参加していないがこんなニュースがメールボックスに入ってきた。
Cardiac Remodeling Following Ligation of Arteriovenous Fistula in Stable Renal Transplant Recipients: a Randomised Controlled Study. Abstract 19322
発表は著者がインタビューを受けるくらい(リンク内にYouTube動画あり)だから、かなり注目されたのだろう。
これは、腎移植後1年が経過し、安定したグラフト機能があって、もう透析することはないと見込まれるのなら、「保険」としてシャントを残すメリットよりも、心負荷のデメリットのほうが大きいんじゃないですか?という問いに答えるスタディだ。
約30例ずつのランダム化で結紮群と非結紮群をくらべたところ、6ヵ月後に結紮群で心MRI上左室筋肉量がマイナス11g/m2と有意に減少した。左室筋肉量は心血管死の代理マーカーとして確立しており、これは相当インパクトのある数字だ。ほかにも、左房容積がさがる(心房細動になりにくい)、ANP・BNPなどの心筋ホルモン値の低下などがみられた。
そうはいっても、移植患者さんのシャントを閉じるというのは相当覚悟のいることで、(シャント感染など他の理由がない限り)まずやらない。この発表が大きく取り上げられたのも、そのためである。
移植業界は施設間で診療の差が大きいが、このオーストラリア発のパイロットスタディから、グラフト生着率のよい時代にあわせ移植医療がかわっていくかもしれない(下図は英エコノミスト誌2018年10月27日付のオーストラリア特集号)。
2018/11/22
心臓が悪い人は腎臓も悪いのか?? 〜前編〜
腎臓の増悪を腎臓内科としては防ぐことが重要である。
腎臓が悪くなる原因に色々とあるが、心臓が悪いというのは一つ大きな原因として見かける。
今回は、慢性腎不全(CKD: Chronic Kidney Disease)と心機能が低下している人について考えてみる。
ある症例を見てみよう。
もともと慢性腎臓病で腎臓内科外来に通院していた80歳男性。この男性は、高血圧と心筋梗塞の既往があり循環器内科にも通院している。心臓に関しては収縮機能の低下した心不全(HFrEF: Heart Failure with reduced Ejection Fraction)として管理されている。内服薬はアスピリン、βブロッカー、ループ利尿薬、スタチン、ARBを内服している。バイタルは、血圧:118/70mmHg、心拍数:62回/分、呼吸数:16回/分。身体所見上は軽度のpitting edemaを下肢にに認めるが、JVPの上昇などは認めていない。生活の中では、悪い時にはNYHA class Ⅱの症状を夜間に感じるが朝には改善するとのこと。
もともと外来では血清Cr:1.3-1.6mg/dL程度であったが、ここ2年間では2.1-2.3mg/dLと増悪を認めている。特に尿蛋白定量や尿所見での新たな異常の出現はない。。
心機能に関しては心エコー所見でEF 38%であった。
ここで疑問がわく。
◆これは、心腎症候群 (CRS: Cardio Renal Syndrome)なのだろうけど、HFrEFの患者でCKDを持っている人はどのくらいなのだろうか??
◆この人にとってベストな治療はなんだろうか??
CRSの機序に関しては、下記の図が非常にまとまっている。
このような場面は、よく遭遇する機会が多い。今回はこの部分を少し考えれたらと思う。
・まず、HFとCKDが共に起こる割合はどうか?
–これに関しては、年齢上昇とともに並存する割合は増加する。また、高血圧、糖尿病、心血管疾患、腎疾患などのリスクファクターに強く影響を受ける。
☆エビデンスとして・・
ADHERE(The Acute Decompensated Heart Failure National Registry)の報告から、12万人のうっ血性心不全で入院した患者の半数以上がCKDの並存があったとしている。
HFrEF、HFpEF( Heart Failure with preserved Ejection Fraction)の患者が混合しているが、25の研究のメタアナリシスで55%の患者が、CKDを有していることが示された。
→なので、まず最初の疑問のどのくらいかに関しては50-60%の割合で持っていることがわかる。
・では、このように高率で併存する場合に何か悪いことがあるのだろうか?
–これに関しては、腎機能の低下と死亡率の上昇は先行研究によって示されている。下図が非常にわかりやすいが、CKDのステージが進行すると共にこの場合は生存割合は減少することがわかる。
別のデータ(USRDS)からもCKD患者の40%以上が慢性心不全を併発するのに対し、CKDがない患者では20%未満になることもわかっている。(下図)
なので、我々は腎不全の進行を抑えることは心不全の併発の割合を抑えているんだなーと感じながら管理をする必要がある。
ただ、腎機能だけを見ているわけにはいかず、ARIC(The Atherosclerosis Risk in Communicate) studyから、尿中のAlbumin/Cr比が心不全発生に関与していることも示されているため、尿中のデータも見て行く必要がある。
では、次の疑問のどのように管理すれば適切なのかであるが、今日は長くなってしまったので次回にしようと思う。
何かコメントあれば、Twitterにぜひ!
https://twitter.com/Kiseki_jinzo
とても、commonではあるが非常に重要なテーマなのかなと思う。
腎臓が悪くなる原因に色々とあるが、心臓が悪いというのは一つ大きな原因として見かける。
今回は、慢性腎不全(CKD: Chronic Kidney Disease)と心機能が低下している人について考えてみる。
ある症例を見てみよう。
もともと慢性腎臓病で腎臓内科外来に通院していた80歳男性。この男性は、高血圧と心筋梗塞の既往があり循環器内科にも通院している。心臓に関しては収縮機能の低下した心不全(HFrEF: Heart Failure with reduced Ejection Fraction)として管理されている。内服薬はアスピリン、βブロッカー、ループ利尿薬、スタチン、ARBを内服している。バイタルは、血圧:118/70mmHg、心拍数:62回/分、呼吸数:16回/分。身体所見上は軽度のpitting edemaを下肢にに認めるが、JVPの上昇などは認めていない。生活の中では、悪い時にはNYHA class Ⅱの症状を夜間に感じるが朝には改善するとのこと。
もともと外来では血清Cr:1.3-1.6mg/dL程度であったが、ここ2年間では2.1-2.3mg/dLと増悪を認めている。特に尿蛋白定量や尿所見での新たな異常の出現はない。。
心機能に関しては心エコー所見でEF 38%であった。
ここで疑問がわく。
◆これは、心腎症候群 (CRS: Cardio Renal Syndrome)なのだろうけど、HFrEFの患者でCKDを持っている人はどのくらいなのだろうか??
◆この人にとってベストな治療はなんだろうか??
CRSの機序に関しては、下記の図が非常にまとまっている。
 |
| AJKDより引用 |
このような場面は、よく遭遇する機会が多い。今回はこの部分を少し考えれたらと思う。
・まず、HFとCKDが共に起こる割合はどうか?
–これに関しては、年齢上昇とともに並存する割合は増加する。また、高血圧、糖尿病、心血管疾患、腎疾患などのリスクファクターに強く影響を受ける。
☆エビデンスとして・・
ADHERE(The Acute Decompensated Heart Failure National Registry)の報告から、12万人のうっ血性心不全で入院した患者の半数以上がCKDの並存があったとしている。
HFrEF、HFpEF( Heart Failure with preserved Ejection Fraction)の患者が混合しているが、25の研究のメタアナリシスで55%の患者が、CKDを有していることが示された。
→なので、まず最初の疑問のどのくらいかに関しては50-60%の割合で持っていることがわかる。
・では、このように高率で併存する場合に何か悪いことがあるのだろうか?
–これに関しては、腎機能の低下と死亡率の上昇は先行研究によって示されている。下図が非常にわかりやすいが、CKDのステージが進行すると共にこの場合は生存割合は減少することがわかる。
なので、我々は腎不全の進行を抑えることは心不全の併発の割合を抑えているんだなーと感じながら管理をする必要がある。
ただ、腎機能だけを見ているわけにはいかず、ARIC(The Atherosclerosis Risk in Communicate) studyから、尿中のAlbumin/Cr比が心不全発生に関与していることも示されているため、尿中のデータも見て行く必要がある。
では、次の疑問のどのように管理すれば適切なのかであるが、今日は長くなってしまったので次回にしようと思う。
何かコメントあれば、Twitterにぜひ!
https://twitter.com/Kiseki_jinzo
とても、commonではあるが非常に重要なテーマなのかなと思う。
2018/11/20
さまざまな血管雑音
腎臓内科医は、じつは腎臓をあまり診察しない。腎臓の診察といえばCVA叩打痛が有名だが、これらが陽性になるのは結石や腎盂腎炎のときだ。また腎臓を両手でお腹と背中から挟むように診察する方法(下図は日内会誌2000 89 2465)もあるが、ADPKDを疑う時などを除き実際はあまりしない。
ではどこを診ているのかと言うと、体液量の評価・血管の評価・膠原病関連の評価になる。体液量は浮腫や頚静脈怒張・hepatojugular refluxなどをみる。膠原病関連は関節・皮疹・紫斑・末梢神経障害・爪周囲の毛細血管など(本家のリウマチ内科に比べればざっくりだろうが)。
血管の評価では、coarctationの有無をざっくり血圧左右差でみたり、足背動脈をふれてPADを疑ったりする。さらに腹部にも聴診器をあてるが、これは腸音よりは血管雑音を聴こうとしている。少し深めにベルを押し当てる人もいるかもしれない。
そこで拍動性でシューシューした音がきこえたら、どうするか?
腎動脈からの音(腎血管性高血圧が示唆される)、大動脈からの音(瘤がみつかるかもしれない)などが疑われるので超音波(検査についてはこちら、腎動脈瘤についてはこちらも参照)やその他の画像検査、また見つかれば治療(実際は内服が最初になることが多い、こちらも参照)などが考慮される。
腎動脈からの音(腎血管性高血圧が示唆される)、大動脈からの音(瘤がみつかるかもしれない)などが疑われるので超音波(検査についてはこちら、腎動脈瘤についてはこちらも参照)やその他の画像検査、また見つかれば治療(実際は内服が最初になることが多い、こちらも参照)などが考慮される。
しかし、シューシューするものがすべて腎臓・大動脈からとは限らない(写真は、シェイクスピア『ヴェニスの商人』で有名になった引用句「輝くものがすべて金とは限らない」)。
そのひとつが、内側弓状靭帯症候群(Median Arcuate Ligament Syndrome、MALS)だ。別名を腹腔動脈起始部圧迫症候群(Celiac Artery Compression Syndrome、CACS)とも言い、同靭帯によって腹腔動脈が圧迫される(図右、引用元はWikipedia英語版)。
この疾患は、原因不明の腹痛が聴診ひとつで診断に至る点で教訓的だ。それもあって、日本(QJM:An Internal Journal of Medicine 2018 111 407)をふくむ各国から多数の報告がある(J Investig Med High Impact Case Rep 2017 5 2324709617728750)。しかし腹腔動脈が圧されている人は全体の10-20%いるとされ(Radiographics 2005 25 1177)、症状がなければ減圧手術などの介入を必要とせず経過観察となる。
ほかにも腹部血管雑音の原因はあるようだ(肝海綿状血管腫の報告はTrop Gastroenterol 1985 6 10)。せっかく聴きに行くのだし、腎臓内科医としてはこれらの鑑別を知っておきたい。さらに部位と音の違いだけで診断できれば、なおカッコいい。
ほかにも腹部血管雑音の原因はあるようだ(肝海綿状血管腫の報告はTrop Gastroenterol 1985 6 10)。せっかく聴きに行くのだし、腎臓内科医としてはこれらの鑑別を知っておきたい。さらに部位と音の違いだけで診断できれば、なおカッコいい。
2018/11/19
チーム・チミーノの栄光
以前、カテーテル関係で英国のショルドン医師とフランス領アルジェリアのオーバニアック医師を紹介した。こんどは、内シャントを語る上でかならず紹介される米国のJames E. Cimino(チミーノ、1928-2010)医師の話をしよう。
彼自身に取材して書かれたRenal and Urology News(2006年10月1日付)も参考にされたい。当初は呼吸生理の研究を志していたチミーノ氏だが、32歳で1960年にブロンクスの退役軍人病院の透析センターを立ち上げを依頼されオファーを受ける。
彼によれば、当時は(今もだが)バスキュラーアクセスは「血液透析のアキレス腱」だった。透析のたび刺していると、刺せる血管がなくなってしまう。それで1959年に開発されたのがScribner-Quintonシャント(写真)だが、外シャントであり閉塞・感染・皮膚壊死などが多発した。
そこで何とかできないかと考えた彼が思い出したのが、学生時代にベルビュー病院でphlebotomist(採血・ルートなどで静脈穿刺する仕事)をしていたときの記憶だった。これは割と有名な話のようだ。
当時、病院にいた多くの朝鮮戦争の退役軍人のなかには損傷によって動静脈瘻(fistula)を持つ患者がいた。そして彼は、そういった血管は穿刺が容易なことを経験として知っていた。
ならば、身体の中で血管どうしを人工的につなげてはどうか?というわけだ(それで、この方式を英語ではシャントといわずfistulaという)。最初は心不全などを怖れて(こちらも参照)静脈-静脈シャントを作成したが、流れが少なくうまく行かない。
心不全は恐ろしい。Do no harmだ。しかし、どれだけ非生理的な流れであっても、バスキュラーアクセスなしでは透析患者さんは「どうしようもない(doomed)」。
それで意を決して橈骨動脈と橈側皮静脈をつないだ。最初の症例は患者の脱水がつよく血圧が低すぎて閉塞した。そのあと試行錯誤を繰り返し、1966年の学会(ASAIO、まだASNはなかった)に発表し、同年論文もだした(NEJM 1966 275 1089)。筆頭著者のブレシア医師は、当初は3年目レジデントとしてチームに参加していた。
そんな若いチームの発表なこともあってか、学会ではほとんど無視されたそうだ。しかし、彼によれば「よいネズミ捕り器はいずれ人々の心を勝ち取る(経済学で、クオリティーが宣伝に勝る意味のことわざ)」もので、数年のうちに大ヒットとなった。いまでもだ(最近はeverlinQ®などの血管内アブレーションも行われるが、原理としてはチミーノ・シャントのバリエーションに過ぎない)。
彼自身はその後、栄養学や緩和ケアの道に進んだが、Calvary Hospitalという米国有数の緩和ケアセンター・グループをつくるなど、どの分野でもパイオニアとして活躍した医師だった。このように現状に満足しないで挑戦する姿勢から学べる点は、多い。改めて冥福をお祈り申し上げる。
 |
| 画像はこちらから |
彼自身に取材して書かれたRenal and Urology News(2006年10月1日付)も参考にされたい。当初は呼吸生理の研究を志していたチミーノ氏だが、32歳で1960年にブロンクスの退役軍人病院の透析センターを立ち上げを依頼されオファーを受ける。
彼によれば、当時は(今もだが)バスキュラーアクセスは「血液透析のアキレス腱」だった。透析のたび刺していると、刺せる血管がなくなってしまう。それで1959年に開発されたのがScribner-Quintonシャント(写真)だが、外シャントであり閉塞・感染・皮膚壊死などが多発した。
 |
| CJASN 2010 5 2146 |
そこで何とかできないかと考えた彼が思い出したのが、学生時代にベルビュー病院でphlebotomist(採血・ルートなどで静脈穿刺する仕事)をしていたときの記憶だった。これは割と有名な話のようだ。
当時、病院にいた多くの朝鮮戦争の退役軍人のなかには損傷によって動静脈瘻(fistula)を持つ患者がいた。そして彼は、そういった血管は穿刺が容易なことを経験として知っていた。
ならば、身体の中で血管どうしを人工的につなげてはどうか?というわけだ(それで、この方式を英語ではシャントといわずfistulaという)。最初は心不全などを怖れて(こちらも参照)静脈-静脈シャントを作成したが、流れが少なくうまく行かない。
心不全は恐ろしい。Do no harmだ。しかし、どれだけ非生理的な流れであっても、バスキュラーアクセスなしでは透析患者さんは「どうしようもない(doomed)」。
それで意を決して橈骨動脈と橈側皮静脈をつないだ。最初の症例は患者の脱水がつよく血圧が低すぎて閉塞した。そのあと試行錯誤を繰り返し、1966年の学会(ASAIO、まだASNはなかった)に発表し、同年論文もだした(NEJM 1966 275 1089)。筆頭著者のブレシア医師は、当初は3年目レジデントとしてチームに参加していた。
そんな若いチームの発表なこともあってか、学会ではほとんど無視されたそうだ。しかし、彼によれば「よいネズミ捕り器はいずれ人々の心を勝ち取る(経済学で、クオリティーが宣伝に勝る意味のことわざ)」もので、数年のうちに大ヒットとなった。いまでもだ(最近はeverlinQ®などの血管内アブレーションも行われるが、原理としてはチミーノ・シャントのバリエーションに過ぎない)。
彼自身はその後、栄養学や緩和ケアの道に進んだが、Calvary Hospitalという米国有数の緩和ケアセンター・グループをつくるなど、どの分野でもパイオニアとして活躍した医師だった。このように現状に満足しないで挑戦する姿勢から学べる点は、多い。改めて冥福をお祈り申し上げる。
2018/11/15
じーんとする学会
ポスター・口演から生涯学習・人脈作りまで、学会に期待するものは沢山あるだろう。しかし、せっかく世界規模の学会に行くからには、「ビックリ・ワクワクするような発見や発表はないかな?」という蓋を開ける前のサスペンスにも期待したい。
そんなわけで今年の米国腎臓学会にもHIGH-IMPACT CLINICAL TRIALS(RESULTS THAT COULD IMPROVE KIDNEY CARE)コーナーがあって、大事な研究成果を研究者から直接聴くことができた。一覧はもう公表されている。
・ DPP4阻害薬リナグリプチンのCKD患者に対する腎保護・心血管系の安全性について(CARMELINA®スタディ)
・透析患者で鉄を高用量静注投与しESA量を下げる試みと、その安全性について(PIVOTALスタディ、DOI: 10.1056/NEJMoa1810742)
・次世代SGLT2阻害薬(ベキサグリフロジン)のステージ3CKD患者への有効性と安全性について
・心臓手術後の輸血戦略を比較したTRICSスタディで、閾値を7g/dlにさげてもAKIは増えな
かったというサブ解析
・カナダで透析導入を遅らせる政策が施行されたあとの影響をしらべた、プラグマティック・スタディ
・炭酸カルシウムと炭酸ランタンをくらべて透析患者の心血管系死への影響を調べたLANDMARKスタディ(開始前の説明はClin Exp Nephrol 2017 21 531)
・透析のうつ病患者にSSRIと認知行動療法(透析中、あるいは個室で)を比較したところSSRIのほうが優れていたというスタディ
PIVOTAL、LANDMARKについては別に考察したい。DPP4阻害薬とSGLT2阻害薬の話は、おそらくそのうち製薬会社の方々から説明されるだろう。透析導入の話は、カナダで巨大な透析レジストリができて、今後さまざまなプラグマティック・スタディが組めるようになったことに意義があるようだった。
いずれも今後が期待されるし、そういう拍手に会場はつつまれた。
しかし、最後のスタディは少しちがった。
結果は私には意外だった。認知行動療法はすべての人には向いていない(宿題をしたり大変)し、透析中にやるのとカウンセリング室でやるのでは効果がちがうのかもしれない。ただ、リハビリなどと一緒で、長生きもさることながら患者さんが透析室に来るのが楽しくハッピーになることを意図した取り組みは、歓迎されるべきだ。
発表のあと、聴衆の一人が「質問ではありませんが」と前置きしたうえで、「あまり誰も気に留めないこの問題に取り組んでくれて、ありがとう」とコメントした。そして、そのあとに暖かな拍手が起きた。
それを聴くのは、2013年アトランタの米国腎臓学会で経験したのにも近い、じーんとする感覚だった。
ワクワク・ドキドキだけでなく、(腎臓だけに?)じーんとするのも学会の醍醐味かもしれない。
そんなわけで今年の米国腎臓学会にもHIGH-IMPACT CLINICAL TRIALS(RESULTS THAT COULD IMPROVE KIDNEY CARE)コーナーがあって、大事な研究成果を研究者から直接聴くことができた。一覧はもう公表されている。
・ DPP4阻害薬リナグリプチンのCKD患者に対する腎保護・心血管系の安全性について(CARMELINA®スタディ)
・透析患者で鉄を高用量静注投与しESA量を下げる試みと、その安全性について(PIVOTALスタディ、DOI: 10.1056/NEJMoa1810742)
・次世代SGLT2阻害薬(ベキサグリフロジン)のステージ3CKD患者への有効性と安全性について
・心臓手術後の輸血戦略を比較したTRICSスタディで、閾値を7g/dlにさげてもAKIは増えな
かったというサブ解析
・カナダで透析導入を遅らせる政策が施行されたあとの影響をしらべた、プラグマティック・スタディ
・炭酸カルシウムと炭酸ランタンをくらべて透析患者の心血管系死への影響を調べたLANDMARKスタディ(開始前の説明はClin Exp Nephrol 2017 21 531)
・透析のうつ病患者にSSRIと認知行動療法(透析中、あるいは個室で)を比較したところSSRIのほうが優れていたというスタディ
PIVOTAL、LANDMARKについては別に考察したい。DPP4阻害薬とSGLT2阻害薬の話は、おそらくそのうち製薬会社の方々から説明されるだろう。透析導入の話は、カナダで巨大な透析レジストリができて、今後さまざまなプラグマティック・スタディが組めるようになったことに意義があるようだった。
いずれも今後が期待されるし、そういう拍手に会場はつつまれた。
しかし、最後のスタディは少しちがった。
結果は私には意外だった。認知行動療法はすべての人には向いていない(宿題をしたり大変)し、透析中にやるのとカウンセリング室でやるのでは効果がちがうのかもしれない。ただ、リハビリなどと一緒で、長生きもさることながら患者さんが透析室に来るのが楽しくハッピーになることを意図した取り組みは、歓迎されるべきだ。
発表のあと、聴衆の一人が「質問ではありませんが」と前置きしたうえで、「あまり誰も気に留めないこの問題に取り組んでくれて、ありがとう」とコメントした。そして、そのあとに暖かな拍手が起きた。
それを聴くのは、2013年アトランタの米国腎臓学会で経験したのにも近い、じーんとする感覚だった。
ワクワク・ドキドキだけでなく、(腎臓だけに?)じーんとするのも学会の醍醐味かもしれない。
2018/11/12
FOAMedステートメント
このブログも、ついに前回で投稿が800件に達した。そこで、私達の立ち位置について少し考えてみよう。このブログは、欧米諸国でここ最近よく聞かれるキーワード、FOAMedの日本語版である。
FOAMedとは、「フリー・オンライン・アクセス・メディカル・エデュケーション」の略である。救急医学で最初にこの言葉がうまれたそうだが(こちらも参照)、要は「分かりやすく面白く知識や経験をウェブに共有して、この世界を少しでも良くしよう」という働きかけだ。「学ぼうとする者には報酬なく医のアートを教えます」というヒポクラテスの誓いを汲んだ行動でもある。
勉強することの多い腎臓内科は、とくにFOAMedが多い(一覧はこちら)。NephJCで注目トピックについてチェックしているという人は、日本にも多いだろう(仕掛け人のブログ、PB Fluidも定評がある)。Nephron Powerは、Kidney Newsに不定期連載しているDetective Nephronの著者が書いているので、それらを通して読むこともできる。
そして、フェローたちが書きたいという気持ちだけで書くRenal Fellow Network(RFN)は、10周年を期にASNと公式にパートナーシップを結んだ(CJASNに取り上げられた、doi.org/10.2215/CJN.06700518)。ややレイアウトが読みづらくなったのは残念だが、今後も発展が期待される。
私達も、2012年にRFNから情熱の灯火を受け継ぎ(こちらも参照)、色々ありましたが、こうしていまも書いています。今後とも続けていく所存ですので、応援くだされば幸いです。
(Twitterアカウントは、@Kiseki_jinzoです)
FOAMedとは、「フリー・オンライン・アクセス・メディカル・エデュケーション」の略である。救急医学で最初にこの言葉がうまれたそうだが(こちらも参照)、要は「分かりやすく面白く知識や経験をウェブに共有して、この世界を少しでも良くしよう」という働きかけだ。「学ぼうとする者には報酬なく医のアートを教えます」というヒポクラテスの誓いを汲んだ行動でもある。
勉強することの多い腎臓内科は、とくにFOAMedが多い(一覧はこちら)。NephJCで注目トピックについてチェックしているという人は、日本にも多いだろう(仕掛け人のブログ、PB Fluidも定評がある)。Nephron Powerは、Kidney Newsに不定期連載しているDetective Nephronの著者が書いているので、それらを通して読むこともできる。
そして、フェローたちが書きたいという気持ちだけで書くRenal Fellow Network(RFN)は、10周年を期にASNと公式にパートナーシップを結んだ(CJASNに取り上げられた、doi.org/10.2215/CJN.06700518)。ややレイアウトが読みづらくなったのは残念だが、今後も発展が期待される。
私達も、2012年にRFNから情熱の灯火を受け継ぎ(こちらも参照)、色々ありましたが、こうしていまも書いています。今後とも続けていく所存ですので、応援くだされば幸いです。
(Twitterアカウントは、@Kiseki_jinzoです)
2018/11/11
Kir
クイズです(写真は1992年まで日本テレビ系列で放送された、アメリカ横断ウルトラクイズ)。
出題者:生活習慣病等の厚生労働大臣が別に定める疾患を主病とする患者について、プライマリケア機能を担う地域のかかりつけ医師が計画的に療養上の管理を 行うことを評価したもので、厚生労働大臣が定める疾患を主病とする患者に対して、治療計画に基づき、服薬、運動、栄養等の療養上の管理を行った場合に、月2回に限り算定できるのは・・・
回答者:「特定疾患療養管理料(ただし許可病床数200 床以上の病院においては算定できない)」!
出題者:ですが、カリウム摂取で血圧が下がるのはなぜでしょう?
回答者:・・・。
カリウム摂取と血圧の関係は疫学で証明され(NEJM 2014 371 601)、クリニックで高血圧の患者さんに「野菜を摂りましょう」といえば上記加算も取れるだろう。しかし、そのメカニズムはどうか?
アルドステロンなどさまざまな要素が関与しているので全貌は分かっていない。ただ、米国腎臓学会の小部屋でおこなわれたWNK(以前も何度か紹介した)セッションに出て、遠位尿細管の間質側にあるKirチャネルがWNKを制御しているらしいことがわかった(写真は辛口白ワインに甘いカシスリキュールを加えたフランスうまれのカクテル、Kir)。
Kirチャネルはカリウムチャネルで、irはinward rectifying(細胞内への一方通行)の略だ。脳で発見されて(初期論文のひとつはNature 1993 362 127)以来、多くのスーパーファミリーが見つかり、さまざまな場所で発現していることがわかっている。
腎臓もそのひとつで、たとえば有名なROMKはKir1.1だ。遠位尿細管の間質側にはKir4.1(遺伝子KCNJ10)とKir5.1(KCNJ16)でできたヘテロ4量体があり、これが血中カリウム濃度を感知していると考えられている。そして、血中濃度がたかいとNCC発現が下がり(下図紫線、JASN 2017 28 1814)、ナトリウム再吸収が落ちる。
Kir4.1遺伝子を腎臓に限りノックアウトするとどうなるか?Kir5.1のヘテロマーはカリウムを通さないこともあり、カリウムセンサーの働きが失われる(上図赤線)。なぜ腎臓に限りノックアウトするかというと、けいれんを起こしてしまうからだ。
この遺伝子異常はヒトでも知られており、EAST症候群(Epilepsy, Ataxia, Sensorineural deafness, Tubulopathy)と呼ばれる(NEJM 2009 360 1960)。NCC発現が減るのでGitelman症候群に似て低K血症、アルカローシスをきたす。
Alport症候群(治験の話はこちら)、Pendred症候群、ループ利尿薬、シスプラチン、アミノグリコシドなどほかにも耳と腎臓に影響する疾患はあるが、EAST症候群もそのひとつとして覚えておきたい。
Kir5.1をノックアウトすると、Kir4.1のホモ4量体はヘテロ4量体と異なりpHに関わらず恒常的にカリウムを通すので、NCCが過剰発現になる(JCI insight 2017 2 pii92331)。その結果、Gitelmanのミラーイメージ、FHHt(Gordon症候群)にちかい病状となる(整理されたものはこちら)。
さらに、間質側のKirが、どうやって反対側(内腔側)のNCC発現を制御しているのかについての話もあった。下図(PNAS 2014 111 11864)にあるように、細胞内クロール濃度、SPAK、KS-WNK1などが関与しているようだが、それはまた。
遠位ネフロンのイオンチャネル研究といえば、もとは腎臓内科の花形(いまは、近位尿細管や腸管のほうが流行りではあるが)。高血圧の健康と社会への影響の大きさを考えても、今後の発展と応用が期待される。
出題者:生活習慣病等の厚生労働大臣が別に定める疾患を主病とする患者について、プライマリケア機能を担う地域のかかりつけ医師が計画的に療養上の管理を 行うことを評価したもので、厚生労働大臣が定める疾患を主病とする患者に対して、治療計画に基づき、服薬、運動、栄養等の療養上の管理を行った場合に、月2回に限り算定できるのは・・・
回答者:「特定疾患療養管理料(ただし許可病床数200 床以上の病院においては算定できない)」!
出題者:ですが、カリウム摂取で血圧が下がるのはなぜでしょう?
回答者:・・・。
カリウム摂取と血圧の関係は疫学で証明され(NEJM 2014 371 601)、クリニックで高血圧の患者さんに「野菜を摂りましょう」といえば上記加算も取れるだろう。しかし、そのメカニズムはどうか?
アルドステロンなどさまざまな要素が関与しているので全貌は分かっていない。ただ、米国腎臓学会の小部屋でおこなわれたWNK(以前も何度か紹介した)セッションに出て、遠位尿細管の間質側にあるKirチャネルがWNKを制御しているらしいことがわかった(写真は辛口白ワインに甘いカシスリキュールを加えたフランスうまれのカクテル、Kir)。
Kirチャネルはカリウムチャネルで、irはinward rectifying(細胞内への一方通行)の略だ。脳で発見されて(初期論文のひとつはNature 1993 362 127)以来、多くのスーパーファミリーが見つかり、さまざまな場所で発現していることがわかっている。
腎臓もそのひとつで、たとえば有名なROMKはKir1.1だ。遠位尿細管の間質側にはKir4.1(遺伝子KCNJ10)とKir5.1(KCNJ16)でできたヘテロ4量体があり、これが血中カリウム濃度を感知していると考えられている。そして、血中濃度がたかいとNCC発現が下がり(下図紫線、JASN 2017 28 1814)、ナトリウム再吸収が落ちる。
Kir4.1遺伝子を腎臓に限りノックアウトするとどうなるか?Kir5.1のヘテロマーはカリウムを通さないこともあり、カリウムセンサーの働きが失われる(上図赤線)。なぜ腎臓に限りノックアウトするかというと、けいれんを起こしてしまうからだ。
この遺伝子異常はヒトでも知られており、EAST症候群(Epilepsy, Ataxia, Sensorineural deafness, Tubulopathy)と呼ばれる(NEJM 2009 360 1960)。NCC発現が減るのでGitelman症候群に似て低K血症、アルカローシスをきたす。
Alport症候群(治験の話はこちら)、Pendred症候群、ループ利尿薬、シスプラチン、アミノグリコシドなどほかにも耳と腎臓に影響する疾患はあるが、EAST症候群もそのひとつとして覚えておきたい。
Kir5.1をノックアウトすると、Kir4.1のホモ4量体はヘテロ4量体と異なりpHに関わらず恒常的にカリウムを通すので、NCCが過剰発現になる(JCI insight 2017 2 pii92331)。その結果、Gitelmanのミラーイメージ、FHHt(Gordon症候群)にちかい病状となる(整理されたものはこちら)。
さらに、間質側のKirが、どうやって反対側(内腔側)のNCC発現を制御しているのかについての話もあった。下図(PNAS 2014 111 11864)にあるように、細胞内クロール濃度、SPAK、KS-WNK1などが関与しているようだが、それはまた。
遠位ネフロンのイオンチャネル研究といえば、もとは腎臓内科の花形(いまは、近位尿細管や腸管のほうが流行りではあるが)。高血圧の健康と社会への影響の大きさを考えても、今後の発展と応用が期待される。
登録:
投稿 (Atom)