ネフロン癆は英語でNephronophthisis(NPH)という。2009年の論文が比較的まとまっている。
この疾患は大まかには
・小児期の末期腎不全の原因の一つ
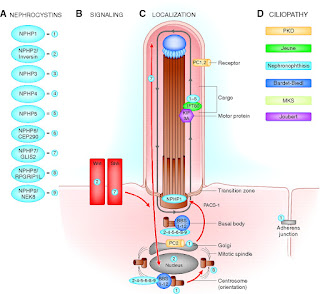
・腎髄質に嚢胞形成を認める疾患であり、原因はPrimary ciliaの異常で他の嚢胞性腎疾患と同様である。
・このprimary ciliaの蛋白合成に関わるNPHP遺伝子の異常に基づくものである。
・病期は多くは下記の3つに分かれる。
−乳児ネフロン癆(3~5歳で末期腎不全に。NPHP2の異常)
−若年性ネフロン癆(13~14歳で末期腎不全に。NPHP1の異常)
−思春期ネフロン癆(19 歳ごろに末期全不全に。NPHP3の異常)
・上記の他にもNPHP遺伝子は13あり、そのほかの変異もある。頻度に関してはNPHP1の異常が最も頻度が多く20%を占め、他の遺伝子異常は各々3%以下で遺伝子変異がわからないものが30%にも及ぶ。
・症状として初期に多飲、多尿、尿最大濃縮能の低下、成長発育障害がある。
・尿細管や集合管のNa喪失のため、低Na血症を認め、他に高K血症を認める。血圧は初期は正常である。
・病理としては尿細管壊死や尿細管基底膜の肥厚所見が認められる。
・腎外症状合併症例もある
−Senior-Loken症候群(網膜色素変性症の合併)
−Cogan症候群(眼球運動の失調合併)
−小脳失調の合併など
・この疾患はほぼ100%末期腎不全に至ってしまう。合併する電解質異常や酸塩基平衡異常などを治療することくらいである。
・見つけるときに学校検尿が役立つかということに関しては病期が進行しないとタンパク尿が認められないことが多いため難しいのが現状である。
なので、若年での腎不全の鑑別にはこのネフロン癆は常に考えるべきである。多尿・多飲のエピソードが事前になかったかは聞くことも重要である。
絶対数としては少ない疾患ではあるが、腎不全が回避できるような治療が見つかればいいと思う。
下記はJASNの論文であるがメカニズムについてよく書かれている。
[2018年6月追記]NPHP遺伝子異常は、いままで考えられていた以上に多いかもしれないことがJASNに示された(doi: 10.1681/ASN.2017111200)。腎移植レシピエントの遺伝子異常を調べるiGeneTRAiNコホートの約5000人にスクリーンを掛けたものだ。
すると、0.5%が二本とも(homozygous)完全欠失しており、この数字はドナーより有意に高かった。とくに若いドナーに多かった。遺伝子欠失がみつかったレシピエントのうち、NPHの診断がついていたのはその1割だったので、9割は見逃されていたことになる。見つかってもいまだ治療は確立していないことを考えると何ともいえないが、診断をつける努力は必要だ。