まずは、下の図は2010年頃の米国の透析患者の死因を表にしたものであるが、見ていただくと心疾患の関連死が非常に高いことがわかる。
では、なぜこんなに多いのかについては、直接的に大きく関わるのは左室肥大である。
よく透析患者で心胸郭比を測定する場面を多く見ると思うが、心胸郭比管理は左室肥大管理で非常に重要である。
では、なぜ左室肥大になるか?
・心筋の線維化や細血管の変化が生じることで生じると言われている。
この原因となるものは、
・貧血、高PTH血症、RAA系の活性増加、FGF23の上昇、リン・カルシウムなどのMBD管理、高血圧、血管の石灰化、volume overloadなどが原因としてはあげられる。
・FGF23はLVHとの関連性に関しては2013年のNDTにも詳しく述べられており非常に重要な要素である。
・血圧に関しては、CLIMB study、DRIP studyで体重増加での血圧の上昇、体重減少での血圧低下が示されている2000年第後半の研究である。
・心筋の変化は剖検での症例(下図)からも腎臓が悪くなるに従い繊維化の増加、血管の数の減少、心筋細胞の割合が減少しているのがわかる。これは、臨床試験でPETを用いたものでも同様の結果が示されている。
 |
| Int J cardiologists 2014より |
透析患者の心臓では(一般的にもだが)、LVHがあること、EFの低下(収縮能の低下)が合併すると死亡リスクは非常に高くなることがわかっている(sem in dial 2003)。
また、2013年のCJASNでもESRDの進行に伴う心機能の変化を見ており、透析患者ではEFの低下が認められる。
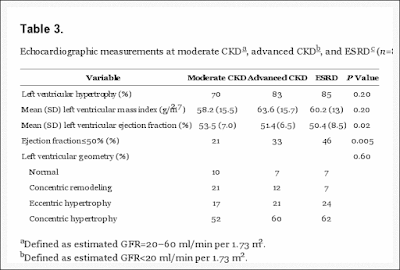 |
| CJASN 2013より |
また、2014のJASNからもCKDのステージが進むにつれて心筋の変化は強くなることもわかっている。
 |
| JASN 2014より |
では、透析患者ではなぜこのように変化が起きやすいのか?
一つのキーワードが"Myocardial Stunning"である。
透析患者では除水をかける以前から心血管血流は低下していると言われ、透析中には心筋虚血が生じ、透析が終了して回復しても心筋壁運動の低下が持続している状態になると言われ、これが心筋の繊維化や心収縮能の低下につながると言われている。下図と論文は非常に秀逸である。
 |
| Rev cardiovasc 2011より |
今回は、治療の話まではできていないが、僕たちができることはこのような現象をおこさいないためにどのようにするかが、透析患者の突然死(以前の投稿)にも直結するのではないかと思う。


