今回の話は、いまだに話題の中心になっているCOVID-19関連の話である。
日本人とは関連が薄いかもしれないが、ApolipoproteinL1(APOL1)を交えての話になる。
APOL1遺伝子変異は黒人に多いことが知られており、また西アフリカの血を引くカリブ諸国やラテンアメリカの人にもよく認められる。APOL1遺伝子に関しては以前の投稿を参照していただきたい。
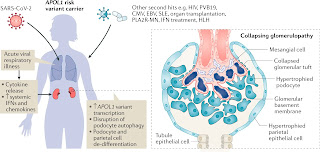
APOL1のG1とG2の2つの変異がある人ではFSGSを発症リスクがOR(Odds Ratio)で10倍、高血圧による腎疾患を起こすORが3倍であることはわかっている。このAPOL1の中でも2つの変異があるリスクの高い患者では何らかの要因がトリガーとなって("Second Hit")、collapsing glomerulopathyを生じるリスクが高い。
何らかの原因によるcollapsing glomerulopathyと聞いてふと思い出されるのは、HIV感染に伴うものであり、組織形態学的にHIVAN(HIV associated nephropathy)ではないであろうか?
HIVANは1980年代に認知され、ネフローゼ症候群と腎不全を伴う疾患である。APOL1遺伝子変異を有している人は、HIVANのリスクが通常よりも30~90倍高いと言われている。HIVだけでなく、パルボウイルスB19、サイトメガロウイルス、EBウイルスなどの感染やSLEなどでもcollapsing glomerulopathyを起こすことがわかっている。
Collapsing glomerulopathyとAPOL1遺伝子変異の関連にインターフェロンが示唆されている。
APOL1遺伝子変異の症例のC型肝炎治療にインターフェロンを用いてcollapsing glomerulopathyが生じたという報告もある。そのメカニズムに関しては現時点ではわかっていない。
COVID-19のケースで、6例のcollapsing glomerulopathyの症例が報告されているが、全症例がAfrican Americanであった。また、APOL1の2つの変異を認めていた。ネフローゼ症候群とAKIを伴っており、臨床所見と病理所見がHIVANに似ていることからCOVAN (Covid-19-associated nephropathy) とこの論文では提唱している。
ただ、通常のCOVID-19に関連するAKIのケースではほとんどがATN(急性尿細管壊死)であるということには留意していただきたい。
もしも、African americanのCOVID-19感染の症例をみて、AKIとネフローゼ症候群を伴っていた場合にはCOVAN!?と是非考えて欲しい。
COVID-19の早期終息を願っている。。



