前回の投稿でsuPARとCKDについて記載した。これは、Nephrologyの2015年のインパクトのあるもので14番目にランクされた(ちなみにこの年の1位はSPRINT trial)。
今回、nature medicineから基礎の分野であるがsuPARに関する論文が発表され、2016年のインパクトのある論文の1位を獲得しているので見ていただきたい。
この論文は
タンパク尿の増加は腎疾患(糖尿病や高血圧や遺伝子異常や薬物や感染や原因不明なもの)の特徴である。suPARは前述した様にCKDの進行や発症に関連がある。例えばFSGSなどとの関連性もある(Nat med 2011)。
しかし、suPARの上昇が未来の腎疾患の予測になるかは不明確であり、今回の論文では骨髄由来のimmature myeloid cellsがsuPAR上昇に関連あるものとして、動物実験でsuPAR高値を持つタンパク尿を有する動物の増加したGr1(lo) myeloid cellsを健康なマウスに導入しsuPARとタンパク尿を有する腎疾患の関連を示すものである。
この論文はとてもよく練られているものであり、今までFSGS(移植後の再発も)やCKDとの関連性が言われていたsuPARがタンパク尿の腎症との関連性があるとのことであり、今後このsuPARを抑えることで腎疾患のコントロールがつきやすくなるのかもしれない。
この様に基礎実験の上に臨床が成り立っていると実感する論文であり、また今後の腎疾患の未来を明るくするものであると感じた。
クマさんがおしっこしないで冬眠できるのも、じん臓が一日に体液の何十倍もろ過してから不要なものを残して再吸収するのも、じん臓の替わりをしてくれる治療があるのも、すごいことです。でも一番のキセキは、こうして腎臓内科をつうじてみなさまとお会いできたこと。その感謝の気持ちをもって、日々の学びを共有できればと思います。投稿・追記など、Xアカウント(@Kiseki_jinzo)でもアナウンスしています。
2016/12/30
2016/12/29
suPARと慢性腎不全(CKD)~NEJMの論文から~
今回この話題を書いたのは、個人的に興味があったのと次の投稿に書かせていただくアメリカのサイトで2016年の論文でインパクトが強かった腎臓の論文に関連するためである。
まず、suPARと慢性腎不全に関しては、NEJMの2015年の論文がいいと思う。
まず、そもそもsuPARに関してだが、suPARはsoluble urokinase-type plasminogen activator receptor の略であり、可溶性ウロキナーゼ型プラスミノーゲン活性化因子受容体である。
suPARに関しては様々な分野で取り上げられている(呼吸器領域や循環器領域や腫瘍領域)。腎臓の領域に関してはsuPARが微小変化群や膜性腎症と異なり、一部のFSGS患者で特異的に上昇している報告がある(CJASN November 07, 2014 vol. 9 no. 11 1903-1911)。
このNEJMの研究では、心カテーテル検査受検者の大規模血液標本登録であるEmory Cardiovascular Biobankから3683例の血中suPAR値を同定し、腎機能を評価(平均年齢 63歳、65%が男性、suPARの中央値が3040pg/ml)。
そのうち2292例で,線形混合モデルを用いてベースライン時のsuPAR値とeGFR,eGFRの変化,CKD発症(eGFR 60mL/分/1.73m2未満と定義)の関連をそれぞれ検討し,Cox回帰モデルにより人口統計学的因子と臨床変数を調整後の相関を解析している。
2016/12/28
血液透析患者とけいれん 治療について
では治療はどうしたらいいであろうか?
□血液透析患者がけいれんした場合に
・血液透析をやめて、必要があれば補液を行い酸素投与を行う。
・透析時に転倒のリスクがない場所に移したり、けいれん中には口に何かを入れない。
・人の応援を呼ぶ(RRSなど)。ほとんどのけいれんは5分以内に頓挫する。
・5分以上持続するなら気道確保やベンゾジアゼピンの点滴を第一選択治療として行う。
□血液検査で血糖・カルシウム・ナトリウム・マグネシウムや他の電解質を検査する。
□予防に関して
・尿毒症性脳症:透析の開始を行う。
・不均衡症候群:グリセオールの使用を行なったり、初回の透析効率を落としたりしてBUNの変動の幅を少なくする。
・エリスロポエチン治療:ヘモグロビンの急激な上昇を避ける。
・透析の低血圧:体重が適切か?心機能はどうか?などをしっかりと評価する。
□抗けいれん薬の開始
通常の場合と同じであるが、初回けいれん時は抗けいれん薬は開始しない場合が多く、2回目以降にけいれんが生じた場合には抗けいれん薬を導入する。
初回けいれんでも
・脳波でてんかんを疑う場合
・脳腫瘍、脳挫傷、中枢神経障害などの原因があり症状を生じる場合。
・睡眠中に初回の発作が生じた場合
などは抗けいれん薬を導入することを考慮する。
□抗けいれん薬は何がいいか?血液透析患者では。
多く使用されるものはレベチラセタム(イーケプラ)である。他の薬物との相互性が少ない。
使用する場合には500-1000mg/dayで使用する。
他のものではラコサミド(ビムパット)も他の薬物との相互性が少ないため有用とされる。
逆にフェニトインやバルプロ酸などは薬物との相互性が多いため血液透析患者では推奨されない。
□透析で抜けるの?
レベチラセタムやラコサミドなどの新しい抗けいれん薬は透析で除去される。そのため、透析後に血中濃度は下がりやすいため、維持できるように管理する必要がある。
けいれん時の薬物に関しては専門的な部分になることも多い。しかし、新しい薬などは把握しておく必要性があるし、逆に薬物の相互作用が大きい薬を使用している場合には中止なども考えなくてはならない。
けいれんは起こるとびっくりすることが多いが、しっかりとした管理をすることが重要である。
□血液透析患者がけいれんした場合に
・血液透析をやめて、必要があれば補液を行い酸素投与を行う。
・透析時に転倒のリスクがない場所に移したり、けいれん中には口に何かを入れない。
・人の応援を呼ぶ(RRSなど)。ほとんどのけいれんは5分以内に頓挫する。
・5分以上持続するなら気道確保やベンゾジアゼピンの点滴を第一選択治療として行う。
□血液検査で血糖・カルシウム・ナトリウム・マグネシウムや他の電解質を検査する。
□予防に関して
・尿毒症性脳症:透析の開始を行う。
・不均衡症候群:グリセオールの使用を行なったり、初回の透析効率を落としたりしてBUNの変動の幅を少なくする。
・エリスロポエチン治療:ヘモグロビンの急激な上昇を避ける。
・透析の低血圧:体重が適切か?心機能はどうか?などをしっかりと評価する。
□抗けいれん薬の開始
通常の場合と同じであるが、初回けいれん時は抗けいれん薬は開始しない場合が多く、2回目以降にけいれんが生じた場合には抗けいれん薬を導入する。
初回けいれんでも
・脳波でてんかんを疑う場合
・脳腫瘍、脳挫傷、中枢神経障害などの原因があり症状を生じる場合。
・睡眠中に初回の発作が生じた場合
などは抗けいれん薬を導入することを考慮する。
□抗けいれん薬は何がいいか?血液透析患者では。
多く使用されるものはレベチラセタム(イーケプラ)である。他の薬物との相互性が少ない。
使用する場合には500-1000mg/dayで使用する。
他のものではラコサミド(ビムパット)も他の薬物との相互性が少ないため有用とされる。
逆にフェニトインやバルプロ酸などは薬物との相互性が多いため血液透析患者では推奨されない。
□透析で抜けるの?
レベチラセタムやラコサミドなどの新しい抗けいれん薬は透析で除去される。そのため、透析後に血中濃度は下がりやすいため、維持できるように管理する必要がある。
けいれん時の薬物に関しては専門的な部分になることも多い。しかし、新しい薬などは把握しておく必要性があるし、逆に薬物の相互作用が大きい薬を使用している場合には中止なども考えなくてはならない。
けいれんは起こるとびっくりすることが多いが、しっかりとした管理をすることが重要である。
2016/12/27
血液透析患者とけいれん 原因などについて
血液透析をしていると色々な合併症に遭遇する。多いのは血圧低下などである。
今回取り上げるけいれんは決して稀なものではない(Pediatr Nephrol. 1992;6(2):182.)。
血液透析患者ではけいれんを引き起こす様々な要因があり、血行動態の変動なども起きやすい。
今回は上記に関して少しまとめてみようと思う。
こんな場面であったらどうしよう?
・いつものように患者さんの透析回診を回っていた。Aさんに「今日の調子はどうですか?」と言ったところ、急にけいれんをしだしてしまった。
この人は新規のけいれんである。
もちろんけいれんを止めることが第一であるが、気道確保とどんなけいれんなのかを確認することはけいれんのfirst stepである。
ここで疑問が。。
血液透析患者と非血液透析患者では対応や評価は何か違うのか?
→これに関しては基本的には同じである。ただ、末期腎不全や血液透析患者では考えておかねばならないけいれんの原因はある。
・尿毒症性脳症・不均衡症候群・透析時血圧不安定・アルミニウム脳症・空気塞栓・低血糖・低カルシウム血症・低ナトリウム血症
などは考える必要がある。
透析患者では頭蓋内病変(出血や梗塞や硬膜外血腫)などは考える必要がある。
特に血液透析患者においては下記は頻度が高いのでチェックする必要がある。
・尿毒症性脳症:適切な透析開始後に数日から数週間で神経症状が改善する。
・不均衡症候群:BUNが高値な症例(170mg/dlや60mmol/L以上)や初回透析時にリスクが高い。
・エリスロポエチン刺激因子:EPO刺激因子による血圧上昇により高血圧性脳症を起こす(Int J Artif Organs. 1994;17(1):5.)。しかし、メタアナリシスではESA使用で増加はないとも言われている(J Am Soc Nephrol. 2004;15(12):3154.)。血圧問題ない人にESA投与でけいれんの発症が増えるエビデンスはない。
・薬剤や毒性:様々なものがけいれんを起こす。抗生物質(ペニシリン、セファロスポリン、エトラペネム)、テオフィリン、L-Dopa、リチウム、アシクロビル、高用量のヨード造影剤、カルバマゼピン、メトクロプラミドなどは起こす。そのほかにも多種の薬が起こしうる。
・透析認知症:アルミニウム脳症が少なくなってからは少ない。
透析患者のけいれんを見たときには、通常の鑑別は重要ではあるが特殊なものも考えるべきであり、それは腎臓内科医は知っておかなくてはならないと感じる。
今回取り上げるけいれんは決して稀なものではない(Pediatr Nephrol. 1992;6(2):182.)。
血液透析患者ではけいれんを引き起こす様々な要因があり、血行動態の変動なども起きやすい。
今回は上記に関して少しまとめてみようと思う。
こんな場面であったらどうしよう?
・いつものように患者さんの透析回診を回っていた。Aさんに「今日の調子はどうですか?」と言ったところ、急にけいれんをしだしてしまった。
この人は新規のけいれんである。
もちろんけいれんを止めることが第一であるが、気道確保とどんなけいれんなのかを確認することはけいれんのfirst stepである。
ここで疑問が。。
血液透析患者と非血液透析患者では対応や評価は何か違うのか?
→これに関しては基本的には同じである。ただ、末期腎不全や血液透析患者では考えておかねばならないけいれんの原因はある。
・尿毒症性脳症・不均衡症候群・透析時血圧不安定・アルミニウム脳症・空気塞栓・低血糖・低カルシウム血症・低ナトリウム血症
などは考える必要がある。
透析患者では頭蓋内病変(出血や梗塞や硬膜外血腫)などは考える必要がある。
特に血液透析患者においては下記は頻度が高いのでチェックする必要がある。
・尿毒症性脳症:適切な透析開始後に数日から数週間で神経症状が改善する。
・不均衡症候群:BUNが高値な症例(170mg/dlや60mmol/L以上)や初回透析時にリスクが高い。
・エリスロポエチン刺激因子:EPO刺激因子による血圧上昇により高血圧性脳症を起こす(Int J Artif Organs. 1994;17(1):5.)。しかし、メタアナリシスではESA使用で増加はないとも言われている(J Am Soc Nephrol. 2004;15(12):3154.)。血圧問題ない人にESA投与でけいれんの発症が増えるエビデンスはない。
・薬剤や毒性:様々なものがけいれんを起こす。抗生物質(ペニシリン、セファロスポリン、エトラペネム)、テオフィリン、L-Dopa、リチウム、アシクロビル、高用量のヨード造影剤、カルバマゼピン、メトクロプラミドなどは起こす。そのほかにも多種の薬が起こしうる。
・透析認知症:アルミニウム脳症が少なくなってからは少ない。
透析患者のけいれんを見たときには、通常の鑑別は重要ではあるが特殊なものも考えるべきであり、それは腎臓内科医は知っておかなくてはならないと感じる。
2016/12/26
腎移植後の免疫抑制剤:ステロイドはいらない?
腎臓の移植は移植を受ける人にとっては、透析をしている人であれば透析での時間の制約から脱却することができるし、また多くの内服薬を必要としなくなる。(腎不全の人ではリンの薬や降圧薬などたくさん。。)
しかし、移植を受ける人は免疫抑制剤を飲み続けなければならない。一生である。
基本的にはカルシニューリン阻害薬(主にはタクロリムス)、ミコフェノール酸モフェチル(セルセプト)、ステロイドが移植後の免疫抑制剤の維持療法で重要な薬となってくる。
移植直後は腎移植の拒絶反応を抑制するために抗体製剤を使用することが多く、バジリキシマブ(シムレクト)が日本では主に使われる。抗ヒト胸腺細胞ウサギ免疫グロブリン(サイモグロブリン)は日本では使えないが米国では中心的に使われている。
今回、LANCETにHARMONY trialというものが出た。
これは、2008年から2013年までの期間で615人に介入したRCTである。
介入群は3つに分けられ
A:シムレクト投与を行い、タクロリムス・セルセプト・ステロイドの維持療法を行う
B:シムレクト投与を行い、タクロリムス・セルセプト投与を行い、8日目にステロイドの投与を終了する。
C:サイモグロブリン投与を行い、タクロリムス・セルセプト投与を行い、8日目にステロイドの投与を終了する。
患者対象は18-75歳までで、免疫のリスクが低い症例(ABO適合症例など)である。
妊婦などは除外。
一次評価項目:12ヶ月での急性拒絶反応の有無
二次評価項目:グラフト生着率やグラフト機能、NODAT(移植後の糖尿病)の割合、収縮期・拡張期血圧、脂質、体重、移植後感染、悪性腫瘍の割合、傷の治りなどを評価
結論
移植後1年でサイモグロブリン投与はシムレクト投与に比べて有用性がすごく高いというものはない。
免疫のリスクが低い症例ではステロイドの早期の中止は特にやめない場合と異なり優位な差はない。逆に糖尿病のリスクを低下させた。
これは、シムレクトとサイモグロブリンを比較したRCTでは初めてのものである。
限界点としては、症例数がもう少し必要、腎病理の読む人の技量がバラバラ、タクロリムスの血中濃度にばらつきがある、プロトコール腎生検は強制的なものでないなどがある。
患者は内服薬を減らせれば、薬のコンプライアンスもよくなるはずである。
僕らがしっかりとそうできるように努力することが、大事である。
しかし、移植を受ける人は免疫抑制剤を飲み続けなければならない。一生である。
基本的にはカルシニューリン阻害薬(主にはタクロリムス)、ミコフェノール酸モフェチル(セルセプト)、ステロイドが移植後の免疫抑制剤の維持療法で重要な薬となってくる。
移植直後は腎移植の拒絶反応を抑制するために抗体製剤を使用することが多く、バジリキシマブ(シムレクト)が日本では主に使われる。抗ヒト胸腺細胞ウサギ免疫グロブリン(サイモグロブリン)は日本では使えないが米国では中心的に使われている。
今回、LANCETにHARMONY trialというものが出た。
これは、2008年から2013年までの期間で615人に介入したRCTである。
介入群は3つに分けられ
A:シムレクト投与を行い、タクロリムス・セルセプト・ステロイドの維持療法を行う
B:シムレクト投与を行い、タクロリムス・セルセプト投与を行い、8日目にステロイドの投与を終了する。
C:サイモグロブリン投与を行い、タクロリムス・セルセプト投与を行い、8日目にステロイドの投与を終了する。
患者対象は18-75歳までで、免疫のリスクが低い症例(ABO適合症例など)である。
妊婦などは除外。
一次評価項目:12ヶ月での急性拒絶反応の有無
二次評価項目:グラフト生着率やグラフト機能、NODAT(移植後の糖尿病)の割合、収縮期・拡張期血圧、脂質、体重、移植後感染、悪性腫瘍の割合、傷の治りなどを評価
結論
移植後1年でサイモグロブリン投与はシムレクト投与に比べて有用性がすごく高いというものはない。
免疫のリスクが低い症例ではステロイドの早期の中止は特にやめない場合と異なり優位な差はない。逆に糖尿病のリスクを低下させた。
これは、シムレクトとサイモグロブリンを比較したRCTでは初めてのものである。
限界点としては、症例数がもう少し必要、腎病理の読む人の技量がバラバラ、タクロリムスの血中濃度にばらつきがある、プロトコール腎生検は強制的なものでないなどがある。
患者は内服薬を減らせれば、薬のコンプライアンスもよくなるはずである。
僕らがしっかりとそうできるように努力することが、大事である。
2016/12/25
腎移植後に血液が濃くなる??(post transplant erythrocytosis)
腎の移植後に血液が濃縮される症例を見たことがあるだろうか?
Posttransplant erythrocytosis(PTE)という。2003年のreviewがあり、それを中心にまとめさせていただいた。
PTEとは腎移植後に持続的にヘモグロビンやヘマトクリットが上昇する病態
塞栓などなく6ヶ月以上持続する。
PTEの疫学
・腎移植のレシピエントに移植後8-15%の割合で生じる。多い報告だと22%と言われる。
・移植後8-24ヶ月後に生じる。
・グラフトの障害を一般的に来さない。
・PTEの報告は減少している(1993-1996までは19%で、1997-2005までは8%であった。)
PTEのリスクファクター
・男性
・拒絶を起こしていない
・腎機能が保持されている
・喫煙やDMなどもリスクをあげる報告がある。
・膵腎同時移植もリスクが上昇する。
ちなみに移植非関連性のerythrocytosisには腎細胞癌、乳癌、肝細胞癌、COPD、脳血管腫などがある。
PTEの原因
・様々なものが関連していると考えられており、現時点でははっきりとした原因は不明。
下記のホルモンが関連があると言われている。
・エリスロポエチン
・ヘマトポエチン成長因子(IGF1;インスリン成長因子、sSCF:血清幹細胞因子)
・RAS(レニンアンギオテンシン系)
・アンドロゲン
多くの研究で上記に対してACE-IやARBが腎移植後のエリスロポエチンの産生を抑制することがわかっている。機序ははっきりとわかってはいないが。
PTEの症状
PTE発症後治療なく、2年で1/4は症状が改善してくる。ただ、残りの人たちは何年も症状が持続し、腎機能障害も来たしてくる。
・60%の症例で症状があり、気分不良、頭痛、無気力、多血症症状、めまいなどが見られる。
・10-30%が血栓症状を呈する。
・1-2%が合併症で亡くなる場合がある。
PTEの治療
・Hb<18.5g/dL:ARBやACE-Iは治療の方法の一つ。どちらを選択するかに関しては患者や処方医の判断でいいとされている。ACE-IのがHb降下作用は強く、好まれる。
処方例として
ロサルタン 50mg/dayで開始。100mg/dayまで増量。
それでも改善なければ、エナラプリルに変更し、10-49mg/dayで加える。
・Hb>18.5g/dLは瀉血を行い、ACE-IやARBを導入する。
・ACE-IやARBが効かない時:テオフィリンは効果があると言われている。
腎移植後の血球増加を見たときに、PTEはしっかりと念頭に置いておかなくてはならない疾患である。
自分もしっかりと知識を積んで見たときに驚かないようにしていきたいと感じた。
Posttransplant erythrocytosis(PTE)という。2003年のreviewがあり、それを中心にまとめさせていただいた。
PTEとは腎移植後に持続的にヘモグロビンやヘマトクリットが上昇する病態
塞栓などなく6ヶ月以上持続する。
PTEの疫学
・腎移植のレシピエントに移植後8-15%の割合で生じる。多い報告だと22%と言われる。
・移植後8-24ヶ月後に生じる。
・グラフトの障害を一般的に来さない。
・PTEの報告は減少している(1993-1996までは19%で、1997-2005までは8%であった。)
PTEのリスクファクター
・男性
・拒絶を起こしていない
・腎機能が保持されている
・喫煙やDMなどもリスクをあげる報告がある。
・膵腎同時移植もリスクが上昇する。
ちなみに移植非関連性のerythrocytosisには腎細胞癌、乳癌、肝細胞癌、COPD、脳血管腫などがある。
PTEの原因
・様々なものが関連していると考えられており、現時点でははっきりとした原因は不明。
下記のホルモンが関連があると言われている。
・エリスロポエチン
・ヘマトポエチン成長因子(IGF1;インスリン成長因子、sSCF:血清幹細胞因子)
・RAS(レニンアンギオテンシン系)
・アンドロゲン
多くの研究で上記に対してACE-IやARBが腎移植後のエリスロポエチンの産生を抑制することがわかっている。機序ははっきりとわかってはいないが。
PTEの症状
PTE発症後治療なく、2年で1/4は症状が改善してくる。ただ、残りの人たちは何年も症状が持続し、腎機能障害も来たしてくる。
・60%の症例で症状があり、気分不良、頭痛、無気力、多血症症状、めまいなどが見られる。
・10-30%が血栓症状を呈する。
・1-2%が合併症で亡くなる場合がある。
PTEの治療
・Hb<18.5g/dL:ARBやACE-Iは治療の方法の一つ。どちらを選択するかに関しては患者や処方医の判断でいいとされている。ACE-IのがHb降下作用は強く、好まれる。
処方例として
ロサルタン 50mg/dayで開始。100mg/dayまで増量。
それでも改善なければ、エナラプリルに変更し、10-49mg/dayで加える。
・Hb>18.5g/dLは瀉血を行い、ACE-IやARBを導入する。
・ACE-IやARBが効かない時:テオフィリンは効果があると言われている。
腎移植後の血球増加を見たときに、PTEはしっかりと念頭に置いておかなくてはならない疾患である。
自分もしっかりと知識を積んで見たときに驚かないようにしていきたいと感じた。
2016/12/24
利尿剤が効かない!?(利尿剤抵抗性について考える) パート3
利尿薬抵抗性の症例を見たときにアルゴリズムがあるといいなと思うのは僕だけだろうか?
アルゴリズムはその流れに乗ればある程度うまくできるので好きなのだが、もちろんしっかりとなぜこのようなアルゴリズムになっているかなどを考えなくてはいけないと思う。
今回、アルゴリズムを乗せる。
1:アドヒアランスの不良やNSAIDsの使用はないかチェック!!
2:食事で塩分制限はできているか?
3:症例のPK,PDの点から考えて一回の利尿薬の投与量を増量したほうがいいのか回数を増やしたほうがいいのかを考える。
4:経口のループ利尿薬を使用し、ダメなら違う作用の利尿薬を加える(遠位尿細管の薬や近位尿細管作動薬など)
5:点滴投与を考える。ダメなら持続投与も考える。
パート2を読んでいただいた方にはスッと内容が理解できるであろう。
利尿薬抵抗性を乗り越えるために重要な点は
・2つの作用タイプの利尿薬を使用する(ループ利尿薬がファーストライン治療薬)。
・肝硬変症例であればフロセミドとスピロノラクトンの併用が様々なデータの蓄積がある。
・肝硬変以外の併用薬に関してはエビデンスが少ない。なので、小規模の研究からサイアザイドをセカンドラインの治療薬をして推奨されている。
・タンパク尿が出ている症例ではプラスミンの働きでENaCの活性が生じているので、ENaC阻害薬がいいかもしれない。
また、アセタゾラミドがペンドリンの阻害を起こすのでセカンドラインではどうだろうという意見もある。
本当に浮腫は悩まされるし、難しい。
ちなみに今回の症例はフロセミドの投与を行いつつ(しっかりと量と回数を注意して)、あとENaCを阻害するトリアムテレンを使用し、浮腫の改善を認めた。
つまり、今回の症例は
ネフローゼ、慢性腎不全、ENaC亢進などが主に利尿薬抵抗性に関連していたのだろう。
あと、ポイントとして利尿薬はスピロノラクトンとトルバプタン以外は糸球体濾過を受けずに近位尿細管から基本的には分泌されて作用するのはポイントだろう!
どうであろうか?
かなり深く抵抗性に関してかかせていただいた。腎臓内科は利尿薬使用のスペシャリストとしてしっかりと把握しなくてはと常に思う。
アルゴリズムはその流れに乗ればある程度うまくできるので好きなのだが、もちろんしっかりとなぜこのようなアルゴリズムになっているかなどを考えなくてはいけないと思う。
今回、アルゴリズムを乗せる。
2:食事で塩分制限はできているか?
3:症例のPK,PDの点から考えて一回の利尿薬の投与量を増量したほうがいいのか回数を増やしたほうがいいのかを考える。
4:経口のループ利尿薬を使用し、ダメなら違う作用の利尿薬を加える(遠位尿細管の薬や近位尿細管作動薬など)
5:点滴投与を考える。ダメなら持続投与も考える。
パート2を読んでいただいた方にはスッと内容が理解できるであろう。
利尿薬抵抗性を乗り越えるために重要な点は
・2つの作用タイプの利尿薬を使用する(ループ利尿薬がファーストライン治療薬)。
・肝硬変症例であればフロセミドとスピロノラクトンの併用が様々なデータの蓄積がある。
・肝硬変以外の併用薬に関してはエビデンスが少ない。なので、小規模の研究からサイアザイドをセカンドラインの治療薬をして推奨されている。
・タンパク尿が出ている症例ではプラスミンの働きでENaCの活性が生じているので、ENaC阻害薬がいいかもしれない。
また、アセタゾラミドがペンドリンの阻害を起こすのでセカンドラインではどうだろうという意見もある。
本当に浮腫は悩まされるし、難しい。
ちなみに今回の症例はフロセミドの投与を行いつつ(しっかりと量と回数を注意して)、あとENaCを阻害するトリアムテレンを使用し、浮腫の改善を認めた。
つまり、今回の症例は
ネフローゼ、慢性腎不全、ENaC亢進などが主に利尿薬抵抗性に関連していたのだろう。
あと、ポイントとして利尿薬はスピロノラクトンとトルバプタン以外は糸球体濾過を受けずに近位尿細管から基本的には分泌されて作用するのはポイントだろう!
どうであろうか?
かなり深く抵抗性に関してかかせていただいた。腎臓内科は利尿薬使用のスペシャリストとしてしっかりと把握しなくてはと常に思う。
2016/12/23
利尿剤が効かない!?(利尿剤抵抗性について考える) パート2
先ほどの症例をみてどうだっただろうか??
この症例にはいくつかの利尿薬の抵抗性を起こす機序がある。
まずは、利尿薬に関しては、作用部位に沿った薬がある。
・近位尿細管:炭酸脱水素酵素阻害薬(アセタゾラミド)
・ヘンレループ:ループ利尿薬(フロセミド、ブメタニド、トルセミドなど)
・遠位尿細管:サイアザイド利尿薬(Na-Cl阻害薬)
・遠位のカリウム保持性利尿薬は2つに分かれる
-ENac blocker:トリアムテレン
-ミネラルコルチコイド阻害薬:スピロノラクトン、エプレレノン
まず、PK(薬物動態学:Pharmacokinetics)、PD(薬力学:Pharmacodynamics)を把握することが大事である。
ちなみに
PK:薬物の吸収、分布、代謝、排泄にフォーカスを絞っている。
PD:薬物の作用部位における反応性を見ている。
ネフローゼ症候群や心不全や肝硬変では腸管浮腫などが生じ吸収障害が生じる。
ネフローゼ症候群では低アルブミン血症になることが多く、ループ利尿薬はアルブミンとの親和性が高いため、効果が減弱する。
CKD患者では、尿酸やアシドーシスや有機酸の影響で利尿薬の分泌が障害される。
心不全や肝硬変では腎血管の血流低下が生じる。
つまり、心不全、肝硬変、腎臓に利尿薬が届きにくいネフローゼ症候群などは、利尿薬の量を増やしてもダメで(届きにくいから。。)、投与回数を頻回にすることが重要である。
逆に慢性腎不全の症例では、届いてはいるからしっかりと分泌を阻害されないぐらいに一回量を使うことが重要である。
まずこの症例ではネフローゼであり、慢性腎不全でもあるからしっかりと1回量も使わなくてはいけないし、投与間隔も頻回にする必要があるだろう。
また、ネフローゼ症候群では尿細管管腔内のプラスミンが集合管のENacを活性化することが一つの説で言われている。これは、前子癇や抵抗性高血圧、心不全、糖尿病性腎症でも見られる。
このENac活性化によってNaの貯留などにつながる。
ここまでで、腎不全、ネフローゼですでに3つの薬物抵抗性の機序が浮かび上がっている。
今日はここまで。
この症例にはいくつかの利尿薬の抵抗性を起こす機序がある。
まずは、利尿薬に関しては、作用部位に沿った薬がある。
・近位尿細管:炭酸脱水素酵素阻害薬(アセタゾラミド)
・ヘンレループ:ループ利尿薬(フロセミド、ブメタニド、トルセミドなど)
・遠位尿細管:サイアザイド利尿薬(Na-Cl阻害薬)
・遠位のカリウム保持性利尿薬は2つに分かれる
-ENac blocker:トリアムテレン
-ミネラルコルチコイド阻害薬:スピロノラクトン、エプレレノン
まず、PK(薬物動態学:Pharmacokinetics)、PD(薬力学:Pharmacodynamics)を把握することが大事である。
ちなみに
PK:薬物の吸収、分布、代謝、排泄にフォーカスを絞っている。
PD:薬物の作用部位における反応性を見ている。
ネフローゼ症候群や心不全や肝硬変では腸管浮腫などが生じ吸収障害が生じる。
ネフローゼ症候群では低アルブミン血症になることが多く、ループ利尿薬はアルブミンとの親和性が高いため、効果が減弱する。
CKD患者では、尿酸やアシドーシスや有機酸の影響で利尿薬の分泌が障害される。
心不全や肝硬変では腎血管の血流低下が生じる。
つまり、心不全、肝硬変、腎臓に利尿薬が届きにくいネフローゼ症候群などは、利尿薬の量を増やしてもダメで(届きにくいから。。)、投与回数を頻回にすることが重要である。
逆に慢性腎不全の症例では、届いてはいるからしっかりと分泌を阻害されないぐらいに一回量を使うことが重要である。
まずこの症例ではネフローゼであり、慢性腎不全でもあるからしっかりと1回量も使わなくてはいけないし、投与間隔も頻回にする必要があるだろう。
また、ネフローゼ症候群では尿細管管腔内のプラスミンが集合管のENacを活性化することが一つの説で言われている。これは、前子癇や抵抗性高血圧、心不全、糖尿病性腎症でも見られる。
このENac活性化によってNaの貯留などにつながる。
ここまでで、腎不全、ネフローゼですでに3つの薬物抵抗性の機序が浮かび上がっている。
今日はここまで。
2016/12/22
利尿剤が効かない!?(利尿剤抵抗性について考える) パート1
利尿剤は腎臓内科がよく使う薬の一つである。
薬の選択に関してはもちろんであるが、効かない時にどうしよう?と迷うことが多いと思う。今回、AJKDに利尿剤抵抗性についての総評があったので読んでみた。
利尿薬の抵抗性に関しては定義としては
「利尿剤投与を最大量使用しているが、望んだ浮腫の改善がない。」
ものである。
利尿剤抵抗性の原因としては
・診断が間違っている(浮腫が静脈うっ滞やリンパ浮腫など)
・塩分制限や水分の制限が守られていない。
・薬が腎臓に届いていない。
-アドヒアランスが悪い
-量が少なすぎる、投与回数が適切でない
-吸収が悪い(腸管吸収など:ネフローゼ症候群)
・利尿薬分泌の低下
-尿毒素による利尿薬の吸収障害
-腎血流の低下
-腎の機能している範囲の低下
・薬物に腎臓が働かない
-GFRの低下(心不全や肝不全など)
-有効循環血液量の低下
-RAA系の活性化
-NSAIDsの使用(遠位の尿細管での代償性Na再吸収亢進)
症例を提示しよう。
55歳男性で浮腫と呼吸困難で入院。
肝硬変にはいたっていない慢性C型肝炎があり、MPGNで2回再発がある。
MPGNの再発はステロイドと利尿剤の併用で改善していた。
ただ、再発の影響か腎機能に関しては低下して、GFRが37mL/min/1.73m2まで低下。
今回は体重が20kg増加して、腹水も伴っていた。血圧は145/110mmHg
今回の診断としてはネフローゼ症候群の再発と考えられた。
腎生検が施行されて、C型肝炎関連のMPGNの再発が考えられた。
治療でフロセミドの投与を行い、持続まで行ったが体重減少に関してしっかりとした反応がなく、サイアザイド利尿薬なども使用するも反応が乏しい状態であった。
どう考えよう?利尿薬も最大に使ってるのに、、
上の抵抗性のに当てはまるものはあるのか??
次回少しずつ紐解いてみる。
薬の選択に関してはもちろんであるが、効かない時にどうしよう?と迷うことが多いと思う。今回、AJKDに利尿剤抵抗性についての総評があったので読んでみた。
利尿薬の抵抗性に関しては定義としては
「利尿剤投与を最大量使用しているが、望んだ浮腫の改善がない。」
ものである。
利尿剤抵抗性の原因としては
・診断が間違っている(浮腫が静脈うっ滞やリンパ浮腫など)
・塩分制限や水分の制限が守られていない。
・薬が腎臓に届いていない。
-アドヒアランスが悪い
-量が少なすぎる、投与回数が適切でない
-吸収が悪い(腸管吸収など:ネフローゼ症候群)
・利尿薬分泌の低下
-尿毒素による利尿薬の吸収障害
-腎血流の低下
-腎の機能している範囲の低下
・薬物に腎臓が働かない
-GFRの低下(心不全や肝不全など)
-有効循環血液量の低下
-RAA系の活性化
-NSAIDsの使用(遠位の尿細管での代償性Na再吸収亢進)
症例を提示しよう。
55歳男性で浮腫と呼吸困難で入院。
肝硬変にはいたっていない慢性C型肝炎があり、MPGNで2回再発がある。
MPGNの再発はステロイドと利尿剤の併用で改善していた。
ただ、再発の影響か腎機能に関しては低下して、GFRが37mL/min/1.73m2まで低下。
今回は体重が20kg増加して、腹水も伴っていた。血圧は145/110mmHg
今回の診断としてはネフローゼ症候群の再発と考えられた。
腎生検が施行されて、C型肝炎関連のMPGNの再発が考えられた。
治療でフロセミドの投与を行い、持続まで行ったが体重減少に関してしっかりとした反応がなく、サイアザイド利尿薬なども使用するも反応が乏しい状態であった。
どう考えよう?利尿薬も最大に使ってるのに、、
上の抵抗性のに当てはまるものはあるのか??
次回少しずつ紐解いてみる。
2016/12/21
ウロジラチン(Urodilatin)について
ウロジラチンという言葉を聞いたことがあるだろうか?今回浮腫の成因のoverfilling に伴う浮腫でこの話が出てきたときなんだろ?と思った。
恥ずかしながら私は知らなかったので、今回の話題に触れてみた。
簡単にいうとウロジラチンはNa利尿ペプチドの一種である。
ナトリウム利尿ペプチドに関しては3つの異なった遺伝子によって作成され、3つの異なった様式で蓄積される。その形がANP(atrial natriuretic peptide),BNP(brain natriuretic peptide),CNP(C-type natriuretic peptide)である。
ANP前駆体ホルモンは4つのペプチドであるが、BNPやCNPは単一のホルモンから生成されている。ANPはこの4つのペプチドの99-126の部分が切断されて生成される。
ウロジラヂンは腎臓でANP前駆体ホルモン(1-126)によって異なる経路で産生される。産生部位は腎臓の遠位尿細管や集合管で産生される。ANP前駆ホルモンの95-126の断片である。ウロジラチンは商品でウラリチドというものである。
AKIやCKDでの尿量が低下した症例に対して、血清Crを下げたり尿量増加を起こしたりするホルモンとして知られている。
ウロジラチンに関しては分かっていないことも多々あるが、知っておくと良いと感じた。
恥ずかしながら私は知らなかったので、今回の話題に触れてみた。
簡単にいうとウロジラチンはNa利尿ペプチドの一種である。
ナトリウム利尿ペプチドに関しては3つの異なった遺伝子によって作成され、3つの異なった様式で蓄積される。その形がANP(atrial natriuretic peptide),BNP(brain natriuretic peptide),CNP(C-type natriuretic peptide)である。
ANP前駆体ホルモンは4つのペプチドであるが、BNPやCNPは単一のホルモンから生成されている。ANPはこの4つのペプチドの99-126の部分が切断されて生成される。
ウロジラヂンは腎臓でANP前駆体ホルモン(1-126)によって異なる経路で産生される。産生部位は腎臓の遠位尿細管や集合管で産生される。ANP前駆ホルモンの95-126の断片である。ウロジラチンは商品でウラリチドというものである。
AKIやCKDでの尿量が低下した症例に対して、血清Crを下げたり尿量増加を起こしたりするホルモンとして知られている。
ウロジラチンに関しては分かっていないことも多々あるが、知っておくと良いと感じた。
2016/12/20
腎動脈瘤(RAA:renal artery aneurysm)について。手術適応や疾患概念に関して。
腎動脈瘤は意外と分かりづらいことが多い。
超音波検査でわかることもあるが、技師さんの腕による部分もあるのではないかと個人的には思う。なので、実際に僕たちが遭遇するときの注意点と治療をどう考えるかを簡単にまとめてみた。個人的にはこのReviewがよくまとまっていると感じた。
・RAAの頻度
成人で1%程度と低いが実際のところは不明であるそうだ。剖検をして見つかる場合なども多い。血管造影検査やCT検査で偶然に見つかる割合としては0.3-2.5%程度。
・RAAの経過
ゆっくりと大きくなる(0.06-0.6mm/year)。
剖検例での腎動脈破裂の報告はない。
非妊娠例での破裂の割合は3-5%で死亡率は10%未満
・原因
繊維筋異形成(35%)
遺伝疾患(Ehlers-Danlon症候群、Kawasaki病)(20%)
感染(梅毒感染)
外傷
手術による損傷
・臨床症状とリスクファクター
60歳以上に典型的に見られる。
女性の割合が72%以上
繊維筋異形成の割合が68%にも及ぶ
症状を呈することは稀(4-23%):腹痛や背部痛や血尿
臨床所見としては:高血圧、腎動脈狭窄音聴取、拍動性の腹部の腫瘤
キーとしては多くの患者が高血圧がある!(なので、若い女性の高血圧を見た際にはこれを鑑別診断の一つにあげることは重要!)
慢性腎不全で発見される患者の割合が4-14%。
側副動脈瘤が7-30%の割合で見られる。
・形など
ほとんどが紡錘状
2/3が動脈の分枝に認められる。
しばしば多発性で10-20%で両側性に見られ、非腎動脈瘤は7-30%
18-68%は石灰化病変を伴っている
8-11%に血栓塞栓を起こしうる。
・治療
無症状:進行速度の経過を見て、初回との増大速度があまりにも早い場合などは手術適応を考える。
症状あり:
・疼痛:NSAIDsやオピオイド
・高血圧:リジノプリルなどのACE-I
・1-1.5cmであれば1−2年のフォローで経過を見ていく。
・1.5cm以上であればコイル塞栓の適応:分岐部は良い適応
・手術:2cm以上の瘤や腎梗塞併発症例や腎動脈破裂症例、本幹の動脈瘤
腎動脈瘤はやはり見つけられればいいが、難しい。
高齢者に多いということであり、高血圧があっても高齢だからと片付けてしまい見つけづらいのかもしれない。
しっかりと病気をうたがえる目を養うことは本当に重要である。
超音波検査でわかることもあるが、技師さんの腕による部分もあるのではないかと個人的には思う。なので、実際に僕たちが遭遇するときの注意点と治療をどう考えるかを簡単にまとめてみた。個人的にはこのReviewがよくまとまっていると感じた。
・RAAの頻度
成人で1%程度と低いが実際のところは不明であるそうだ。剖検をして見つかる場合なども多い。血管造影検査やCT検査で偶然に見つかる割合としては0.3-2.5%程度。
・RAAの経過
ゆっくりと大きくなる(0.06-0.6mm/year)。
剖検例での腎動脈破裂の報告はない。
非妊娠例での破裂の割合は3-5%で死亡率は10%未満
・原因
繊維筋異形成(35%)
遺伝疾患(Ehlers-Danlon症候群、Kawasaki病)(20%)
感染(梅毒感染)
外傷
手術による損傷
・臨床症状とリスクファクター
60歳以上に典型的に見られる。
女性の割合が72%以上
繊維筋異形成の割合が68%にも及ぶ
症状を呈することは稀(4-23%):腹痛や背部痛や血尿
臨床所見としては:高血圧、腎動脈狭窄音聴取、拍動性の腹部の腫瘤
キーとしては多くの患者が高血圧がある!(なので、若い女性の高血圧を見た際にはこれを鑑別診断の一つにあげることは重要!)
慢性腎不全で発見される患者の割合が4-14%。
側副動脈瘤が7-30%の割合で見られる。
・形など
ほとんどが紡錘状
2/3が動脈の分枝に認められる。
しばしば多発性で10-20%で両側性に見られ、非腎動脈瘤は7-30%
18-68%は石灰化病変を伴っている
8-11%に血栓塞栓を起こしうる。
・治療
無症状:進行速度の経過を見て、初回との増大速度があまりにも早い場合などは手術適応を考える。
症状あり:
・疼痛:NSAIDsやオピオイド
・高血圧:リジノプリルなどのACE-I
・1-1.5cmであれば1−2年のフォローで経過を見ていく。
・1.5cm以上であればコイル塞栓の適応:分岐部は良い適応
・手術:2cm以上の瘤や腎梗塞併発症例や腎動脈破裂症例、本幹の動脈瘤
腎動脈瘤はやはり見つけられればいいが、難しい。
高齢者に多いということであり、高血圧があっても高齢だからと片付けてしまい見つけづらいのかもしれない。
しっかりと病気をうたがえる目を養うことは本当に重要である。
2016/12/19
バンコマイシンと急性腎機能障害(Acute kidney injury:AKI)を考える。
今回バンコマイシンとAKIの件を書こうと思ったのは、日常でよく遭遇するのと、CJASNの論文で取り上げられていたからである。
そもそもバンコマイシンの歴史は1958年に最初に認可された。
ラットの研究で大量のバンコマイシンを投与した一部が腎機能障害を呈したが、他のは腎機能障害を呈さなかったという報告がある(Antimicrob Agents Chemother 30: 20–24, 1986)。
アミノグリコシドとの併用は腎毒性を惹起したと言われ、これは腎の刷子縁にくっついたことによるものと考えられている。それにエンドトキシンが作用していると。
バンコマイシンによる腎機能障害というと想像されるのは尿細管障害であるが、実際に腎生検をしてみると間質障害の方が多かったという報告が多い。間質障害は基本的には容量依存ではなく、反応によるものである。
また、バンコマイシンの血中濃度はバンコマイシンは未変化体で75-90%腎臓で排泄されるためGFRに依存する。
日常で相談されるのは
A「腎機能が悪くなっているのですが、どうしましょう?今、感染症の治療でバンコマイシンの治療を行なっています。バンコマイシンのトラフ値が25とかなり高くて今は少し中止して、再度採血をする予定です。」
この時にやはり悩むのは腎機能障害の原因である。
もちろん他の腎機能障害の原因の薬物や造影剤の使用の有無や循環の変動がなかったかはまずは除外するべきであるが、それがなかった場合にバンコマイシンは本当に腎毒性になるのか?と常に悩む。
今回のCJASNの論文ではsystematic reviewとmeta analysisでこれを考えている。
ちなみに
システマティックレビュー:特定の疑問に関して数多くの研究を網羅的に再現性のある方法に従って集めて、その時点の結果のまとめを行なったもの
メタアナリシス:集められた複数の研究の結果を統計学的手法を用いて統合したものである。
今回の論文のようにメタアナリシスが行われているシステマティックレビューは個々の研究結果の羅列にとどまらず結論を導き出すことができ結論の信頼度が高くなる。
今回の論文ではRCTやコホート研究を取り出し、1990年から2005年までPubMedやCochrane Libraryで抽出したものである。
Funnel PlotもRCTの部分のみではあるがしっかりばらけている。
この論文では最終的に13の論文を検討している(7個がRCTで6個がコホート研究)。
結果ではバンコマイシンによるAKIリスクは相対危険度で2.45(95%信頼区間:1.69-3.55)と関連性を認めた。
また、感染部位としては皮膚や軟部組織感染で使用する場合と肺炎や多臓器感染で使用する場合のAKIのリスクの違いはなかった。
ただ、様々なバイアスはあるため、この著者たちはエビデンスとしてはとても強いものではないが、関連性があるという形で示されている。
バンコマイシンの腎機能障害には本当かな?と常に思いながら診療してきたが、エビデンスはそこまでにせよ、関連性があるということに納得する論文であった。
そもそもバンコマイシンの歴史は1958年に最初に認可された。
ラットの研究で大量のバンコマイシンを投与した一部が腎機能障害を呈したが、他のは腎機能障害を呈さなかったという報告がある(Antimicrob Agents Chemother 30: 20–24, 1986)。
アミノグリコシドとの併用は腎毒性を惹起したと言われ、これは腎の刷子縁にくっついたことによるものと考えられている。それにエンドトキシンが作用していると。
バンコマイシンによる腎機能障害というと想像されるのは尿細管障害であるが、実際に腎生検をしてみると間質障害の方が多かったという報告が多い。間質障害は基本的には容量依存ではなく、反応によるものである。
また、バンコマイシンの血中濃度はバンコマイシンは未変化体で75-90%腎臓で排泄されるためGFRに依存する。
日常で相談されるのは
A「腎機能が悪くなっているのですが、どうしましょう?今、感染症の治療でバンコマイシンの治療を行なっています。バンコマイシンのトラフ値が25とかなり高くて今は少し中止して、再度採血をする予定です。」
この時にやはり悩むのは腎機能障害の原因である。
もちろん他の腎機能障害の原因の薬物や造影剤の使用の有無や循環の変動がなかったかはまずは除外するべきであるが、それがなかった場合にバンコマイシンは本当に腎毒性になるのか?と常に悩む。
今回のCJASNの論文ではsystematic reviewとmeta analysisでこれを考えている。
ちなみに
システマティックレビュー:特定の疑問に関して数多くの研究を網羅的に再現性のある方法に従って集めて、その時点の結果のまとめを行なったもの
メタアナリシス:集められた複数の研究の結果を統計学的手法を用いて統合したものである。
今回の論文のようにメタアナリシスが行われているシステマティックレビューは個々の研究結果の羅列にとどまらず結論を導き出すことができ結論の信頼度が高くなる。
今回の論文ではRCTやコホート研究を取り出し、1990年から2005年までPubMedやCochrane Libraryで抽出したものである。
Funnel PlotもRCTの部分のみではあるがしっかりばらけている。
この論文では最終的に13の論文を検討している(7個がRCTで6個がコホート研究)。
結果ではバンコマイシンによるAKIリスクは相対危険度で2.45(95%信頼区間:1.69-3.55)と関連性を認めた。
また、感染部位としては皮膚や軟部組織感染で使用する場合と肺炎や多臓器感染で使用する場合のAKIのリスクの違いはなかった。
ただ、様々なバイアスはあるため、この著者たちはエビデンスとしてはとても強いものではないが、関連性があるという形で示されている。
バンコマイシンの腎機能障害には本当かな?と常に思いながら診療してきたが、エビデンスはそこまでにせよ、関連性があるということに納得する論文であった。
アンジオテンシン阻害薬(ARB/ACE-I)の慢性腎不全(CKD)への使用を考える パート2
前回RAS阻害薬による血圧降下までの話をした。
今回は腎保護について考えてみたい。
・腎保護の観点でACE-IとARBの違いはある。これは"AngⅡ escape"によると考えられている。ACE-Iでブロックしても前述した違う経路でAngⅡは産生される。対して、ARBは直接的にAT1やAngⅡを阻害するのでAngⅡ産生は抑制される。
なら、ARBがいいのかというとそうでもなく、AngⅡの完全ブロックで神経液性因子が働き、他のATレセプター(AT2, AT3, AT4など)にくっついてしまう。これはARBはブロックできない。AT2はAT1と対照的に働きアポトーシスや前炎症状態を起こしたりケモカインさん性などが言われている。ARB阻害はこんな状態を起こしうる危険もある。
ACE-IとARBのdouble blockが両者の悪いところを補填するので理論的に良いとされているのはこのためである(AJKD 2009)。
・タンパク尿産生に関して
ACE-IやARB使用によるタンパク産生抑制は様々な研究で報告されている(Ann inter med 2008)。ACE-I、ARBは比較しても同等であ理、両者の併用療法が効果が高かったと報告されている。
少しstudyを紹介する。
・MARVAL trial:ディオバンがアムロジンよりも尿中タンパク排泄を減らした(インスリン必要としないDM患者) (Circulation 2002)
・LIFE study:ニューロタンがアテノロールと比較してアルブミン尿を減らした(高血圧の患者)(J Hypertention 2004)。
・MICRO-HOPE study:ラミプリル(ACE-I)使用でAlb/Cr比の低下を認め、心血管イベント減少や腎保護作用を認めた(DM患者)(LANCET 2000)
・BENEDIC trial:トランドラプリル微量タンパク尿を減少させた(Cont clin trial 2003)
・IRMA2 study:アバプロがアルブミン尿の進展を抑えた(インスリン必要としないDM患者)(NEJM 2001)
尿蛋白には早期から使用した方がいいことがわかる。
・腎機能保護に関して
腎機能保護に関しても様々な歴史の上に積み重なっている。
・RENAAL study:アルブミン尿の低下が腎保護につながっており、下げれば下げる程腎保護に役立ってた(KI 2004)。
・IDN trial:アバプロ使用でアムロジピン使用に比して腎不全リスクを低下させた(AJKD 2005)。
・AIPRI trial:様々な腎疾患の患者に対してベナゼプリルが腎機能低下を抑えた(J Cardio Pharm 1999)
・REIN trial:ラミプリルが血圧低下と比例して腎保護に働いた(Lancet 1998)
他の研究で血圧と相関なく腎保護があることがわかった(NEJM 2006)。
・AASK trial;高血圧性腎症でラミプリルがGFR低下を緩め、特にアルブミン尿が200mg/day以上で有効だった(JAMA 2002)
糖尿病腎症ではどのタンパク尿のステージでもRAS阻害薬の使用が腎保護という観点で有効なことが示されている。
・Double blockに関しては使用によりAKIの増加や高カリウム血症の出現があり、効果もそこまで強くなく推奨度は低い(NEJM 2013)
そのため、結論としては腎臓の保護に関して血圧のコントロールは重要であり、その際に選択されるのはRAS系阻害薬である。もちろん使用に伴う弊害(Kのことや腎機能の一時的な悪化がないか)などをモニターしながら投与がいいと感じる。
なので、腎機能が悪い=躊躇というのは避けるべきであろう。
RAS系の併用に関しては理論的には有用であるが、現時点での推奨度は低いなと感じた。
とても、奥の深い領域だなと感じた。
今回は腎保護について考えてみたい。
・腎保護の観点でACE-IとARBの違いはある。これは"AngⅡ escape"によると考えられている。ACE-Iでブロックしても前述した違う経路でAngⅡは産生される。対して、ARBは直接的にAT1やAngⅡを阻害するのでAngⅡ産生は抑制される。
なら、ARBがいいのかというとそうでもなく、AngⅡの完全ブロックで神経液性因子が働き、他のATレセプター(AT2, AT3, AT4など)にくっついてしまう。これはARBはブロックできない。AT2はAT1と対照的に働きアポトーシスや前炎症状態を起こしたりケモカインさん性などが言われている。ARB阻害はこんな状態を起こしうる危険もある。
ACE-IとARBのdouble blockが両者の悪いところを補填するので理論的に良いとされているのはこのためである(AJKD 2009)。
・タンパク尿産生に関して
ACE-IやARB使用によるタンパク産生抑制は様々な研究で報告されている(Ann inter med 2008)。ACE-I、ARBは比較しても同等であ理、両者の併用療法が効果が高かったと報告されている。
少しstudyを紹介する。
・MARVAL trial:ディオバンがアムロジンよりも尿中タンパク排泄を減らした(インスリン必要としないDM患者) (Circulation 2002)
・LIFE study:ニューロタンがアテノロールと比較してアルブミン尿を減らした(高血圧の患者)(J Hypertention 2004)。
・MICRO-HOPE study:ラミプリル(ACE-I)使用でAlb/Cr比の低下を認め、心血管イベント減少や腎保護作用を認めた(DM患者)(LANCET 2000)
・BENEDIC trial:トランドラプリル微量タンパク尿を減少させた(Cont clin trial 2003)
・IRMA2 study:アバプロがアルブミン尿の進展を抑えた(インスリン必要としないDM患者)(NEJM 2001)
尿蛋白には早期から使用した方がいいことがわかる。
・腎機能保護に関して
腎機能保護に関しても様々な歴史の上に積み重なっている。
・RENAAL study:アルブミン尿の低下が腎保護につながっており、下げれば下げる程腎保護に役立ってた(KI 2004)。
・IDN trial:アバプロ使用でアムロジピン使用に比して腎不全リスクを低下させた(AJKD 2005)。
・AIPRI trial:様々な腎疾患の患者に対してベナゼプリルが腎機能低下を抑えた(J Cardio Pharm 1999)
・REIN trial:ラミプリルが血圧低下と比例して腎保護に働いた(Lancet 1998)
他の研究で血圧と相関なく腎保護があることがわかった(NEJM 2006)。
・AASK trial;高血圧性腎症でラミプリルがGFR低下を緩め、特にアルブミン尿が200mg/day以上で有効だった(JAMA 2002)
糖尿病腎症ではどのタンパク尿のステージでもRAS阻害薬の使用が腎保護という観点で有効なことが示されている。
・Double blockに関しては使用によりAKIの増加や高カリウム血症の出現があり、効果もそこまで強くなく推奨度は低い(NEJM 2013)
そのため、結論としては腎臓の保護に関して血圧のコントロールは重要であり、その際に選択されるのはRAS系阻害薬である。もちろん使用に伴う弊害(Kのことや腎機能の一時的な悪化がないか)などをモニターしながら投与がいいと感じる。
なので、腎機能が悪い=躊躇というのは避けるべきであろう。
RAS系の併用に関しては理論的には有用であるが、現時点での推奨度は低いなと感じた。
とても、奥の深い領域だなと感じた。
2016/12/17
アンジオテンシン阻害薬(ARB/ACE-I)の慢性腎不全(CKD)への使用を考える パート1
今回、この題材にしたのは自分の知識が不足しているからである。
恥ずかしながら僕の認識ではあまり慢性腎不全にアンジオテンシン阻害薬の投与は推奨されないのではないかと自己解釈していた。
・腎不全でのRAA系の変化
腎不全になると早期:腎臓の炎症が生じる→尿細管間質障害が生じる→尿細管壊死が生じる→子宮体硬化が生じると考えられている。
その時にRAAS(Renin-Angiotensin-Aldosteron system)は各々に対して重要な因子として働いている。
・RAA系の考え方
以前はRAASは血圧の関連や集合管でのNa吸収に関連しているものだと思われてきていた。
しかし、現在RAASはとっても複雑になっている。(ACEがAngⅡ合成の重要な要因と考えたれていたが、代替経路も存在する:Chymase, chymostatin-sensitive AngⅡ generating enzyme(CAGE), ACE2など)、Ang Ⅲ, Ang Ⅳ, Ang 1-9 , Ang 1-7などの新しいタンパクも見つかっている。
なので、ACE-IのよるAngⅡ産生抑制は腎臓内のAngⅡ産生抑制には関連しないとも言われている(JASN 2002)。
腎臓内の部分的なAngⅡが高血圧や腎臓の廃絶に関連していると言われている(濾過圧の上昇や輸出細動脈の収縮や自動調節能障害などを起こす)
・血圧降下に対して
慢性腎不全に対する血圧降下に関しては、様々な研究で有用性が分かっている(Eur heart journal 2003)。また、両者の薬の作用の違いは血圧の観点では同様と言われている(Ann intern med 2008)。
ACE-IとARBの両者の併用に関してはACE-I単独と比較して4.7/3.0mmHg、ARB単独と比較して3.8/2.9mmHgと血圧の点では低下を認めることが分かっている(Hypertention 2005)。
今日はまずはここまでにしておこう。
本当に僕たちの診療は日々進化している。患者さんにとって良い治療を選択できるように努力しよう!
恥ずかしながら僕の認識ではあまり慢性腎不全にアンジオテンシン阻害薬の投与は推奨されないのではないかと自己解釈していた。
・腎不全でのRAA系の変化
腎不全になると早期:腎臓の炎症が生じる→尿細管間質障害が生じる→尿細管壊死が生じる→子宮体硬化が生じると考えられている。
その時にRAAS(Renin-Angiotensin-Aldosteron system)は各々に対して重要な因子として働いている。
・RAA系の考え方
以前はRAASは血圧の関連や集合管でのNa吸収に関連しているものだと思われてきていた。
しかし、現在RAASはとっても複雑になっている。(ACEがAngⅡ合成の重要な要因と考えたれていたが、代替経路も存在する:Chymase, chymostatin-sensitive AngⅡ generating enzyme(CAGE), ACE2など)、Ang Ⅲ, Ang Ⅳ, Ang 1-9 , Ang 1-7などの新しいタンパクも見つかっている。
なので、ACE-IのよるAngⅡ産生抑制は腎臓内のAngⅡ産生抑制には関連しないとも言われている(JASN 2002)。
腎臓内の部分的なAngⅡが高血圧や腎臓の廃絶に関連していると言われている(濾過圧の上昇や輸出細動脈の収縮や自動調節能障害などを起こす)
・血圧降下に対して
慢性腎不全に対する血圧降下に関しては、様々な研究で有用性が分かっている(Eur heart journal 2003)。また、両者の薬の作用の違いは血圧の観点では同様と言われている(Ann intern med 2008)。
ACE-IとARBの両者の併用に関してはACE-I単独と比較して4.7/3.0mmHg、ARB単独と比較して3.8/2.9mmHgと血圧の点では低下を認めることが分かっている(Hypertention 2005)。
今日はまずはここまでにしておこう。
本当に僕たちの診療は日々進化している。患者さんにとって良い治療を選択できるように努力しよう!
2016/12/15
透析のシャント感染を考える。
血液透析患者さんに一定頻度で起こる可能性があるものがシャント感染である。
透析患者では、血液透析を行う際に観血的な処置を行い透析を行うため、一定頻度で感染症は生じる。
AVF(自己血管のシャント)では、3年間で70%以上が問題なく使えるし感染の割合も2-3%と言われている。
AVG(人工血管のシャント)では、3年間で50%以上が問題なく使え、感染や血栓で透析ができなくなることが多い。
上記の点から考えてもシャントはAVFの方が良さそうであるが、患者の中には血管の走行が変わっていたりして、自己血管のシャント増設ができない症例も多い。
まず、ここまでで知っておくことは患者さんのシャントが自分の血管なのか人工血管なのかを把握することは重要である。
・所見:発熱、発赤、皮膚バリアの消失、膿や稀だが出血などもある。
シャント感染で皮膚や血管が脆弱になり、出血で救急搬送された症例も経験した。
・感染菌:黄色ブドウ球菌が最多で、表皮ブドウ球菌が次に多い。
・リスク:偽性動脈瘤、血腫、皮膚の掻爬、薬物などをシャントから使用。
特にアクセスのタイプや局所性かなどで治療などは考える選択肢は異なってくる。
AVF,AVGにしても局所感染が最も多く
・AVFで発熱や菌血症を疑わない:抗生剤加療を2週間は少なくとも行う
・AVFで発熱や菌血症の併存が疑わせる:静脈投与の抗生剤を少なくとも4週間以上行い、シャント穿刺は同部位では行わない。2006年のKDOQIのガイドラインでは6週間の抗生剤投与を推奨。
・AVFで感染性血栓や敗血症性塞栓がある:自己血管シャント(感染部)を抜去する。
・AVGであれば常にグラフと抜去は考えないといけない。
静脈投与の抗生剤を用いて少なくとも2-4週間以上は治療するが、多くの場合は外科的な介入でグラフト抜去になる症例が多い。
もし、グラフト抜去後も発熱が持続していた場合には他の原因(骨髄炎や感染性心内膜炎など)や感染の波及などを考える必要がある。感染の波及は起こ
りやすく、また起こした場合には患者の予後は非常に悪いと言われる。
透析患者さんは様々な合併症に注意を払いながら我々も治療を行なっていく必要がある。
透析患者では、血液透析を行う際に観血的な処置を行い透析を行うため、一定頻度で感染症は生じる。
AVF(自己血管のシャント)では、3年間で70%以上が問題なく使えるし感染の割合も2-3%と言われている。
AVG(人工血管のシャント)では、3年間で50%以上が問題なく使え、感染や血栓で透析ができなくなることが多い。
上記の点から考えてもシャントはAVFの方が良さそうであるが、患者の中には血管の走行が変わっていたりして、自己血管のシャント増設ができない症例も多い。
まず、ここまでで知っておくことは患者さんのシャントが自分の血管なのか人工血管なのかを把握することは重要である。
・所見:発熱、発赤、皮膚バリアの消失、膿や稀だが出血などもある。
シャント感染で皮膚や血管が脆弱になり、出血で救急搬送された症例も経験した。
・感染菌:黄色ブドウ球菌が最多で、表皮ブドウ球菌が次に多い。
・リスク:偽性動脈瘤、血腫、皮膚の掻爬、薬物などをシャントから使用。
特にアクセスのタイプや局所性かなどで治療などは考える選択肢は異なってくる。
AVF,AVGにしても局所感染が最も多く
・AVFで発熱や菌血症を疑わない:抗生剤加療を2週間は少なくとも行う
・AVFで発熱や菌血症の併存が疑わせる:静脈投与の抗生剤を少なくとも4週間以上行い、シャント穿刺は同部位では行わない。2006年のKDOQIのガイドラインでは6週間の抗生剤投与を推奨。
・AVFで感染性血栓や敗血症性塞栓がある:自己血管シャント(感染部)を抜去する。
・AVGであれば常にグラフと抜去は考えないといけない。
静脈投与の抗生剤を用いて少なくとも2-4週間以上は治療するが、多くの場合は外科的な介入でグラフト抜去になる症例が多い。
もし、グラフト抜去後も発熱が持続していた場合には他の原因(骨髄炎や感染性心内膜炎など)や感染の波及などを考える必要がある。感染の波及は起こ
りやすく、また起こした場合には患者の予後は非常に悪いと言われる。
透析患者さんは様々な合併症に注意を払いながら我々も治療を行なっていく必要がある。
このシャント感染を書いていると私の恩師とExcitingな経験をした沖縄の冬を思いだす。
2016/12/14
低ナトリウム血症に尿素投与を考える。
低ナトリウム血症の治療は悩む部分が多いし、難しいことが多い。
ご存知のようにガイドラインが2014年に欧州と米国から出ており、欧州のガイドラインがよく引用されており、その中でSIADHの治療に尿素の負荷が推奨されている(推奨は2D)。
In moderate or profound hyponatraemia, we suggest the following can be considered equal second line treatments: increasing solute intake with 0.25–0.50 g/kg/day of urea or a combination of low dose loop diuretics and oral sodium chloride.
では、尿素の負荷はどのように作用するのか?を少し考えてみたいなと思う。
調べてみると意外に尿素の歴史はふるい。。
1950年代に提唱され(この時は受け入れられなかったよう)、1960年代には頭蓋内圧や眼球内圧をあげる治療として標準治療となった。尿素は点滴で投与されていたとのことで、今では想像がつかない。(Urovertという点滴:糖を含有し溶血を防いでいた。)
その後、マンニトールなどが簡便であるということで使用され、Urovertは過去のものとなってしまったらしい。
尿素の点滴は問題が色々とあり、尿素は腸管吸収も良かったことから経口薬として1892年に利尿薬として初めて使用されたまた、1926年の報告では心不全で使用された報告がある。
このように尿素負荷は注目を浴びている。
尿素は有効浸透圧か?
→尿素は非有効浸透圧である。アルコールやエタノールと同じである。
有効浸透圧としてはブドウ糖やマンニトールや高張性造影剤などがある。
血液に尿素が入ると:
尿素に関しては血液中に入っても筋肉細胞や脳細胞などに分布し、血清浸透圧はわずかに上昇はさせ(20mOsm程度)、BBBを介して脳細胞から水が移行する。
しかし、浸透圧格差はすぐに是正される。
理由としては
1:脳細胞内にゆっくりであるが尿素が移行する。
2:尿から尿素排出で尿素が下がる。
尿からの尿素は:
尿素投与ですぐに尿素の排泄が亢進される。腎機能が問題ない方であれば12時間で全てが排泄される。最大尿希釈力から最大排泄尿量がわかるが、溶質負荷に伴い最大排泄尿量が増加する。その際に自由水の排泄が亢進する。
尿素負荷に伴うNa上昇に関しては自由水排泄に伴うものである。
実際3%生理食塩水と比較するとどうかも乗っていたが、3%に関しては希釈尿が上昇した際にovershootする可能性があるが、尿素では少ないとされている。
しかし、尿素の内服はどのようにすればいいのか?美味しくないそうである。
アミノレバンも一つの方法である。これも美味しくないそうである。
美味しくないため患者さんのQOLが極端に落ちたそうである。
とても勉強になる。患者さんにとって一番いい治療が選択できればいいと感じる。
2016/12/13
被嚢性腹膜硬化症〜腹膜炎との関連は?〜
被嚢性腹膜硬化症(Encapsulating peritoneal sclerosis:EPS)は現在ではまれな腹膜透析患者の合併症である。しかし、死亡率の高い疾患であり我々もしっかりと注意して管理する必要がある。
個人的には、なるべく腹膜透析を長くさせてあげたい反面とEPSの発症はどうなのだろうと常に診療の中で気を揉んでいる。
・EPSの歴史:
EPSが報告されたのは、1980年に報告され(Arch.Intern.Med. 140,1201–1203 )、1996年には0.9%、2005年には3.3%に上昇していた。
2009年の報告では0.7-3.3%となっておりやはり一定数の患者はいるため注意する。
やはり、一番は死亡率の高さで25-55%の死亡率があることは知っておかねばならない。
・EPSを考えるときに
腹膜透析患者はもちろんではあるが、非腹膜透析患者にも起こりうる。自己免疫疾患やサルコイドーシスや腹膜や腹部の悪性腫瘍や感染患者、慢性的な肝硬変の腹水患者、β遮断薬投与患者などは考える必要がある。
腹膜透析患者においては単純腹膜硬化症という1st hitの前段階がある状況で、急激なPDの休止や腹膜炎や移植などが2nd HitとなりEPSが発症すると考えられている。
腎移植後のEPSも報告されている(Nephron.Clin.Pract. 111,149–154.)
2016/12/12
血漿交換はどんな疾患に適応?迷った際のワンポイント!!
久々の投稿になります。
今回は血漿交換についての話題に触れたいと思う。
血漿交換を考えるときに、まず何が適応になってどのくらいの回数が保健上適応になっているかは常に考える必要がある。その際に下記のような形でどの疾患が適応あるんだろ?と常に考えると思う。
しかし、この表が頭に入って入れば話は別であるが、この疾患はどうだろ?と考えた際にどのように調べるだろうか?
ここは日本!なので、日本語でとことん探すのも一つであるが、世界標準はどうかを知るのは重要である。
アフェレーシスのガイドラインがあり、2016年度に新しいものが出ている(J Clin apher 2016 Jun;31(3):149-62)。
これの良い点は一つ一つの疾患についてまとめられており、どれくらいの推奨度があるかや置換液をアルブミンにした方が良いのか?FFPにした方が良いのかがわかるところなのかと感じる。
例えば、多発性骨髄腫に伴うcast nephropathyで高度な腎機能障害を呈する人が来たとする。
その際に上の表を見ただけだと多発性骨髄腫という疾患はあるが、多発性骨髄腫だけでできるのか?なんなのかは不明である。
ガイドラインで引くとcast nephropathyは推奨度はGrade2Bとなっている。この疾患に対してやる意味は軽鎖の糸球体への量を低下させることで腎予後、生存率の改善につながる。腹膜透析や高性能膜の血液透析よりも血漿交換の方が軽鎖の除去に関しては効果がある。
では、どのような人に優先的に使用を考えるかというと尿量がある人に関しては、まずは補液治療(2.5-4L/日)であり、尿量が出ていないCre ≧ 6mg/dLの症例などは治療的血漿交換を考慮した方が良いとガイドラインには記載してある。
とても、ひとつひとつの症例に対して細かくどのRCTからエビデンスが抜き出されているかなど書かれており、とても勉強になっている。
ぜひ、迷うことがある際には参考にしていただきたい。
今回は血漿交換についての話題に触れたいと思う。
血漿交換を考えるときに、まず何が適応になってどのくらいの回数が保健上適応になっているかは常に考える必要がある。その際に下記のような形でどの疾患が適応あるんだろ?と常に考えると思う。
しかし、この表が頭に入って入れば話は別であるが、この疾患はどうだろ?と考えた際にどのように調べるだろうか?
ここは日本!なので、日本語でとことん探すのも一つであるが、世界標準はどうかを知るのは重要である。
アフェレーシスのガイドラインがあり、2016年度に新しいものが出ている(J Clin apher 2016 Jun;31(3):149-62)。
これの良い点は一つ一つの疾患についてまとめられており、どれくらいの推奨度があるかや置換液をアルブミンにした方が良いのか?FFPにした方が良いのかがわかるところなのかと感じる。
例えば、多発性骨髄腫に伴うcast nephropathyで高度な腎機能障害を呈する人が来たとする。
その際に上の表を見ただけだと多発性骨髄腫という疾患はあるが、多発性骨髄腫だけでできるのか?なんなのかは不明である。
ガイドラインで引くとcast nephropathyは推奨度はGrade2Bとなっている。この疾患に対してやる意味は軽鎖の糸球体への量を低下させることで腎予後、生存率の改善につながる。腹膜透析や高性能膜の血液透析よりも血漿交換の方が軽鎖の除去に関しては効果がある。
では、どのような人に優先的に使用を考えるかというと尿量がある人に関しては、まずは補液治療(2.5-4L/日)であり、尿量が出ていないCre ≧ 6mg/dLの症例などは治療的血漿交換を考慮した方が良いとガイドラインには記載してある。
とても、ひとつひとつの症例に対して細かくどのRCTからエビデンスが抜き出されているかなど書かれており、とても勉強になっている。
ぜひ、迷うことがある際には参考にしていただきたい。
2016/11/18
慢性の高カリウム血症の治療
外来患者でも高カリウム血症の人によく会うと思う。
特に慢性腎不全の人などは高カリウム血症できて、「また、たくさんカリウム多いもの食べたでしょ〜?」って会話を外来で繰り広げるかもしれない。
まず、高カリウムの主なリスクはなんなのだろう?
・eGFR低下、男性、RAS阻害薬(特にdual RAS 阻害薬)、糖尿病
上記は主なリスク(am j nephrol 2015 41 456-463)になる。
特にdualでの高カリウム血症はNEJMのNEPHRON-Dというものであり、覚えておくといいかと思う。
僕らは急性の高カリウム血症の治療はグルコン酸カルシウムを投与して、GI療法をして、利尿薬を使用してなどとするが、慢性的な高カリウム血症の治療はどうするのがいいのか?
例えば、尿からのカリウム排泄増加として利尿薬やフロリネフなどのミネラルコルチコイド刺激薬などが言われている(kidney Int2009 Oct;76(8):877-84)。
しかし、体液量が低下している人にとっては使用しづらい。
そこで、やはり僕らが使っている陽イオン交換樹脂が一つは出てくる。
一つはカルシウム型でもう一つがナトリウム型である。
カルシウム型は商品名:カリメート、アーガメイトであり、ナトリウム型は商品名:ケイキサレートである。違いは交換がNaとCaで違い、ケイキサレートの方が下痢しやすいなどとも言われるがどうであろう?
イオン交換樹脂でいい点としては正常Kの人には利点はないということである。つまり低カリウムにはしない(J Am. Soc Nephrol 9: 1924-1930. 1998)
新たに薬が出ているのもおさえるべきである。
PatiromertとZirconium cyclosilicateである。
この二つに関しては、様々なRCTが出ているが、それぞれNEJMのは押さえておくと良い。
また、副作用に関してはPatiromerは便秘や低マグネシウム血症があり、Zirconium cyclosilicateは浮腫の副作用があるということは押さえておくといいと思う。
日本には2016年現在認可されていないものではあるが、慢性期の高カリウムの治療も変わると感じる。
特に慢性腎不全の人などは高カリウム血症できて、「また、たくさんカリウム多いもの食べたでしょ〜?」って会話を外来で繰り広げるかもしれない。
まず、高カリウムの主なリスクはなんなのだろう?
・eGFR低下、男性、RAS阻害薬(特にdual RAS 阻害薬)、糖尿病
上記は主なリスク(am j nephrol 2015 41 456-463)になる。
特にdualでの高カリウム血症はNEJMのNEPHRON-Dというものであり、覚えておくといいかと思う。
僕らは急性の高カリウム血症の治療はグルコン酸カルシウムを投与して、GI療法をして、利尿薬を使用してなどとするが、慢性的な高カリウム血症の治療はどうするのがいいのか?
例えば、尿からのカリウム排泄増加として利尿薬やフロリネフなどのミネラルコルチコイド刺激薬などが言われている(kidney Int2009 Oct;76(8):877-84)。
しかし、体液量が低下している人にとっては使用しづらい。
そこで、やはり僕らが使っている陽イオン交換樹脂が一つは出てくる。
一つはカルシウム型でもう一つがナトリウム型である。
カルシウム型は商品名:カリメート、アーガメイトであり、ナトリウム型は商品名:ケイキサレートである。違いは交換がNaとCaで違い、ケイキサレートの方が下痢しやすいなどとも言われるがどうであろう?
イオン交換樹脂でいい点としては正常Kの人には利点はないということである。つまり低カリウムにはしない(J Am. Soc Nephrol 9: 1924-1930. 1998)
新たに薬が出ているのもおさえるべきである。
PatiromertとZirconium cyclosilicateである。
この二つに関しては、様々なRCTが出ているが、それぞれNEJMのは押さえておくと良い。
また、副作用に関してはPatiromerは便秘や低マグネシウム血症があり、Zirconium cyclosilicateは浮腫の副作用があるということは押さえておくといいと思う。
日本には2016年現在認可されていないものではあるが、慢性期の高カリウムの治療も変わると感じる。
2016/11/17
クロールって注目度低い? クロール異常について
クロールの異常はあまり無視してしまうことが多いと思う。
かくいう僕もそうである。
今回書くことが、自分の戒めとみなさんの何か診療につながればと思う。
クロールは前述した通り、濃度で見ていることに注意である。
■低クロール血症:98mEq/L未満をいうらしいが大抵は引っかかりそうである。
−起こること
:ECF低下、細胞内アシドーシス、カリウム低下、重炭酸の産生亢進、血清浸透圧低下
−原因としては
:代謝性アルカローシス、低ナトリウム、フロセミド、サイアザイド、AG上昇性の代謝性アシドーシス、Bartter syndrome、Cystic fibrosisなどが挙げられる。
なので、低クロール血症から診断できる疾患もあるためしっかりと頭の片隅に置いておく。特にフロセミドなどを使用することでのCl depletion alkalosisは重要な概念であり、ブログ内でも記載してあるので、注意して見ていただきたい。
■高クロール血症:108mEq/L以上をいうが以外に多く周りにいるのではないか。
−原因として
:覚えておいてもらいたいのは、Pseudo hyperchloremiaである。つまり本当は上がっていないが、上昇して見えることである。この原因は臭素中毒やヨウ素中毒がある。
なぜ、臭素などでクロールが高くなるかに関しては測定で用いているイオン電極法では臭素がクロールとしてカウントされてしまい測定上は高クロール血症になる。
日本の市販薬(ナロンエース)などにも臭素は含有しているため、大量内服者は注意である。
:そのほかは、生理食塩水の大量投与、自由水欠乏、AG非開大性アシドーシス(トルエン大量服薬などで急峻な酸の陰イオン増加した場合)などがある。
原因からわかるようにある程度病歴などで鑑別は絞れてくる。
そのため、患者さんの話に耳を傾け、クロールにも注目してあげよう!きっと、僕たちが診断をするのに、情報は多い方がいいので。。
かくいう僕もそうである。
今回書くことが、自分の戒めとみなさんの何か診療につながればと思う。
クロールは前述した通り、濃度で見ていることに注意である。
■低クロール血症:98mEq/L未満をいうらしいが大抵は引っかかりそうである。
−起こること
:ECF低下、細胞内アシドーシス、カリウム低下、重炭酸の産生亢進、血清浸透圧低下
−原因としては
:代謝性アルカローシス、低ナトリウム、フロセミド、サイアザイド、AG上昇性の代謝性アシドーシス、Bartter syndrome、Cystic fibrosisなどが挙げられる。
なので、低クロール血症から診断できる疾患もあるためしっかりと頭の片隅に置いておく。特にフロセミドなどを使用することでのCl depletion alkalosisは重要な概念であり、ブログ内でも記載してあるので、注意して見ていただきたい。
■高クロール血症:108mEq/L以上をいうが以外に多く周りにいるのではないか。
−原因として
:覚えておいてもらいたいのは、Pseudo hyperchloremiaである。つまり本当は上がっていないが、上昇して見えることである。この原因は臭素中毒やヨウ素中毒がある。
なぜ、臭素などでクロールが高くなるかに関しては測定で用いているイオン電極法では臭素がクロールとしてカウントされてしまい測定上は高クロール血症になる。
日本の市販薬(ナロンエース)などにも臭素は含有しているため、大量内服者は注意である。
:そのほかは、生理食塩水の大量投与、自由水欠乏、AG非開大性アシドーシス(トルエン大量服薬などで急峻な酸の陰イオン増加した場合)などがある。
原因からわかるようにある程度病歴などで鑑別は絞れてくる。
そのため、患者さんの話に耳を傾け、クロールにも注目してあげよう!きっと、僕たちが診断をするのに、情報は多い方がいいので。。
2016/11/16
腎病理の蛍光染色に関して
腎病理において蛍光染色の理解が自分は不十分である。
蛍光染色は何のためにするか?
:主にタンパクなどの抗原性を有する物質に対して特異的に作用する抗体で抗原抗体反応を起こすことで組織中の物質を検出しようとするもので、これを蛍光抗体法(Immunofluorescence Microscopy:IF)という。これは蛍光色素を標的とするため光る。
これの例としてはIgG,IgM,IgA,C3,C1q,κLC,λLC,C4dなどである。
しかし、逆に不溶性色素を生成する酵素を標的とした抗体を用いる方法が酵素抗体法と呼ばれる。
これの例としてはSV40,CMV,amyroid proteinなどである。
想像はつくだろうか?
あとは、どの疾患に何がつくかではあるが、基本的には糸球体の構造を念頭に置き、係蹄壁かメサンギウム領域につくかを考える。
あとは沈着パターンであり、係蹄壁の沈着が線状か顆粒状かである。
例えば、IgA腎症:メサンギウム領域にIgA、C3沈着がある。膜性腎症では係蹄壁に顆粒状にIgG、C3沈着がある。感染後糸球体腎炎、膜性増殖性腎炎では、メサンギウム領域・係蹄壁にIgG、C3沈着がある。糖尿病性腎症や抗糸球体基底膜抗体症候群は係蹄壁に線状にIgG沈着する。
ただ、基本的には蛍光染色は確定診断となりうるのはIgA腎症やC3腎症などくらいであり、あとは膜性腎症の際の特発性であればIgGのサブクラスでIgG4が優位となるなどの点かと思う(今はPLA2Rもでて、特発性の診断も容易になった。)
まとまったものとしてはheptinstall's Pathology of the kidneyにあるため参考にしていただきたい。
蛍光染色は何のためにするか?
:主にタンパクなどの抗原性を有する物質に対して特異的に作用する抗体で抗原抗体反応を起こすことで組織中の物質を検出しようとするもので、これを蛍光抗体法(Immunofluorescence Microscopy:IF)という。これは蛍光色素を標的とするため光る。
これの例としてはIgG,IgM,IgA,C3,C1q,κLC,λLC,C4dなどである。
しかし、逆に不溶性色素を生成する酵素を標的とした抗体を用いる方法が酵素抗体法と呼ばれる。
これの例としてはSV40,CMV,amyroid proteinなどである。
想像はつくだろうか?
あとは、どの疾患に何がつくかではあるが、基本的には糸球体の構造を念頭に置き、係蹄壁かメサンギウム領域につくかを考える。
あとは沈着パターンであり、係蹄壁の沈着が線状か顆粒状かである。
例えば、IgA腎症:メサンギウム領域にIgA、C3沈着がある。膜性腎症では係蹄壁に顆粒状にIgG、C3沈着がある。感染後糸球体腎炎、膜性増殖性腎炎では、メサンギウム領域・係蹄壁にIgG、C3沈着がある。糖尿病性腎症や抗糸球体基底膜抗体症候群は係蹄壁に線状にIgG沈着する。
ただ、基本的には蛍光染色は確定診断となりうるのはIgA腎症やC3腎症などくらいであり、あとは膜性腎症の際の特発性であればIgGのサブクラスでIgG4が優位となるなどの点かと思う(今はPLA2Rもでて、特発性の診断も容易になった。)
まとまったものとしてはheptinstall's Pathology of the kidneyにあるため参考にしていただきたい。
クロール(Cl)って注目度低い? 機序について
僕は電解質が出来ないながらも好きある。
電解質といえば王道は一価であればナトリウム、カリウムであり、二価であればリン、カルシウム、マグネシウムである。
その中でルーチンで我々が測るクロールについて少し考えてみた。
クロールは細胞外に存在する最も多くの陰イオンであり、高クロール血症はナトリウムと同じように血漿のクロール濃度の上昇と定義されている。
高クロール血症を認めることに弊害はあるのか?
→腎血流量の低下(J Clin Invest. 1983;71:726–35.)、腎臓や消化管の間質浮腫(J Surg Res. 2011;166:120–30.)、重症患者の死亡率の増加(J Crit Care.
2011;26:175–9.)、AKIの患者の回復が悪くなり生存率が低下する(Kidney Int. 2009;76:422–7.)ことが言われている。
では、クロールは濃度を腎臓でコントロールいている。では、腎臓がどのように調整しているのか?
糸球体:クロールは自由に通過
近位尿細管:約60%が再吸収される(S1,S2領域でNaや他の陰イオンが再吸収され、クロールの濃度は上昇し、S3領域で吸収される。もちろん、S1,S2領域でもクロール−anion 高関係があり吸収される)。
ヘンレの太い上行脚:クロールの再吸収に重要な場所である。
遠位尿細管:NCCチャネルでクロールの吸収を行う。
集合菅:重要であり、Naと異なり尿細管と血管の荷電差からクロールの吸収が糸球体傍から生じる。pendrinからもクロールは吸収される。
本当に上記には簡単に記載している。
少し、クロールって意外に重要なんだな?って思っていただけたら嬉しい。
次回は高クロール血症の話に触れたいと思う。
電解質といえば王道は一価であればナトリウム、カリウムであり、二価であればリン、カルシウム、マグネシウムである。
その中でルーチンで我々が測るクロールについて少し考えてみた。
クロールは細胞外に存在する最も多くの陰イオンであり、高クロール血症はナトリウムと同じように血漿のクロール濃度の上昇と定義されている。
高クロール血症を認めることに弊害はあるのか?
→腎血流量の低下(J Clin Invest. 1983;71:726–35.)、腎臓や消化管の間質浮腫(J Surg Res. 2011;166:120–30.)、重症患者の死亡率の増加(J Crit Care.
2011;26:175–9.)、AKIの患者の回復が悪くなり生存率が低下する(Kidney Int. 2009;76:422–7.)ことが言われている。
では、クロールは濃度を腎臓でコントロールいている。では、腎臓がどのように調整しているのか?
糸球体:クロールは自由に通過
近位尿細管:約60%が再吸収される(S1,S2領域でNaや他の陰イオンが再吸収され、クロールの濃度は上昇し、S3領域で吸収される。もちろん、S1,S2領域でもクロール−anion 高関係があり吸収される)。
ヘンレの太い上行脚:クロールの再吸収に重要な場所である。
遠位尿細管:NCCチャネルでクロールの吸収を行う。
集合菅:重要であり、Naと異なり尿細管と血管の荷電差からクロールの吸収が糸球体傍から生じる。pendrinからもクロールは吸収される。
本当に上記には簡単に記載している。
少し、クロールって意外に重要なんだな?って思っていただけたら嬉しい。
次回は高クロール血症の話に触れたいと思う。
2016/10/30
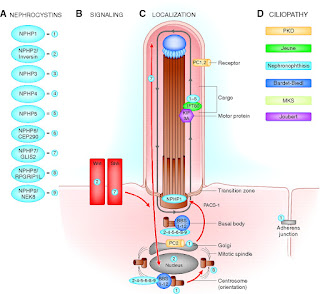
小児期の腎不全で考えること(ネフロン癆)
先日、腎不全の若年者の末期腎不全、電解質異常の症例検討を聞いていた際にネフロン癆は鑑別には挙がりますか?と質問されており、自分の知識がないなと思い記載をしようと思った。
ネフロン癆は英語でNephronophthisis(NPH)という。2009年の論文が比較的まとまっている。
この疾患は大まかには
・小児期の末期腎不全の原因の一つ
・腎髄質に嚢胞形成を認める疾患であり、原因はPrimary ciliaの異常で他の嚢胞性腎疾患と同様である。
・このprimary ciliaの蛋白合成に関わるNPHP遺伝子の異常に基づくものである。
・病期は多くは下記の3つに分かれる。
−乳児ネフロン癆(3~5歳で末期腎不全に。NPHP2の異常)
−若年性ネフロン癆(13~14歳で末期腎不全に。NPHP1の異常)
−思春期ネフロン癆(19 歳ごろに末期全不全に。NPHP3の異常)
・上記の他にもNPHP遺伝子は13あり、そのほかの変異もある。頻度に関してはNPHP1の異常が最も頻度が多く20%を占め、他の遺伝子異常は各々3%以下で遺伝子変異がわからないものが30%にも及ぶ。
・症状として初期に多飲、多尿、尿最大濃縮能の低下、成長発育障害がある。
・尿細管や集合管のNa喪失のため、低Na血症を認め、他に高K血症を認める。血圧は初期は正常である。
・病理としては尿細管壊死や尿細管基底膜の肥厚所見が認められる。
・腎外症状合併症例もある
−Senior-Loken症候群(網膜色素変性症の合併)
−Cogan症候群(眼球運動の失調合併)
−小脳失調の合併など
・この疾患はほぼ100%末期腎不全に至ってしまう。合併する電解質異常や酸塩基平衡異常などを治療することくらいである。
・見つけるときに学校検尿が役立つかということに関しては病期が進行しないとタンパク尿が認められないことが多いため難しいのが現状である。
なので、若年での腎不全の鑑別にはこのネフロン癆は常に考えるべきである。多尿・多飲のエピソードが事前になかったかは聞くことも重要である。
絶対数としては少ない疾患ではあるが、腎不全が回避できるような治療が見つかればいいと思う。
下記はJASNの論文であるがメカニズムについてよく書かれている。
[2018年6月追記]NPHP遺伝子異常は、いままで考えられていた以上に多いかもしれないことがJASNに示された(doi: 10.1681/ASN.2017111200)。腎移植レシピエントの遺伝子異常を調べるiGeneTRAiNコホートの約5000人にスクリーンを掛けたものだ。
すると、0.5%が二本とも(homozygous)完全欠失しており、この数字はドナーより有意に高かった。とくに若いドナーに多かった。遺伝子欠失がみつかったレシピエントのうち、NPHの診断がついていたのはその1割だったので、9割は見逃されていたことになる。見つかってもいまだ治療は確立していないことを考えると何ともいえないが、診断をつける努力は必要だ。

ネフロン癆は英語でNephronophthisis(NPH)という。2009年の論文が比較的まとまっている。
この疾患は大まかには
・小児期の末期腎不全の原因の一つ
・腎髄質に嚢胞形成を認める疾患であり、原因はPrimary ciliaの異常で他の嚢胞性腎疾患と同様である。
・このprimary ciliaの蛋白合成に関わるNPHP遺伝子の異常に基づくものである。
・病期は多くは下記の3つに分かれる。
−乳児ネフロン癆(3~5歳で末期腎不全に。NPHP2の異常)
−若年性ネフロン癆(13~14歳で末期腎不全に。NPHP1の異常)
−思春期ネフロン癆(19 歳ごろに末期全不全に。NPHP3の異常)
・上記の他にもNPHP遺伝子は13あり、そのほかの変異もある。頻度に関してはNPHP1の異常が最も頻度が多く20%を占め、他の遺伝子異常は各々3%以下で遺伝子変異がわからないものが30%にも及ぶ。
・症状として初期に多飲、多尿、尿最大濃縮能の低下、成長発育障害がある。
・尿細管や集合管のNa喪失のため、低Na血症を認め、他に高K血症を認める。血圧は初期は正常である。
・病理としては尿細管壊死や尿細管基底膜の肥厚所見が認められる。
・腎外症状合併症例もある
−Senior-Loken症候群(網膜色素変性症の合併)
−Cogan症候群(眼球運動の失調合併)
−小脳失調の合併など
・この疾患はほぼ100%末期腎不全に至ってしまう。合併する電解質異常や酸塩基平衡異常などを治療することくらいである。
・見つけるときに学校検尿が役立つかということに関しては病期が進行しないとタンパク尿が認められないことが多いため難しいのが現状である。
なので、若年での腎不全の鑑別にはこのネフロン癆は常に考えるべきである。多尿・多飲のエピソードが事前になかったかは聞くことも重要である。
絶対数としては少ない疾患ではあるが、腎不全が回避できるような治療が見つかればいいと思う。
下記はJASNの論文であるがメカニズムについてよく書かれている。
[2018年6月追記]NPHP遺伝子異常は、いままで考えられていた以上に多いかもしれないことがJASNに示された(doi: 10.1681/ASN.2017111200)。腎移植レシピエントの遺伝子異常を調べるiGeneTRAiNコホートの約5000人にスクリーンを掛けたものだ。
すると、0.5%が二本とも(homozygous)完全欠失しており、この数字はドナーより有意に高かった。とくに若いドナーに多かった。遺伝子欠失がみつかったレシピエントのうち、NPHの診断がついていたのはその1割だったので、9割は見逃されていたことになる。見つかってもいまだ治療は確立していないことを考えると何ともいえないが、診断をつける努力は必要だ。
2016/10/27
Free water clearance(FWC 自由水クリアランス ), Electrolyte free water clearance(EFWC)
以前にもこのブログに書いてあるが、今回自分の勉強も兼ねて再度書かせていただく。
腎臓でどのくらいfree waterを排出していることを知ることは、低ナトリウム血症の治療予測や高ナトリウム血症の治療計画に有用である。
尿中の全溶質が排出されるのに必要な分時あたりの血漿量を浸透圧クリアランス(Cosm)という。
Cosm(ml/min)=(Uosm×UV)÷Posm となる。
※ Uosm:尿中浸透圧、UV:尿量、Posm:血漿浸透圧である。
FWCを考えるときにわかりやすいのは、尿を溶質の部分と自由水(free water)の部分に分けるとわかりやすい。
つまり尿量と浸透圧クリアランスの差が溶質を含まないFWCになる。
FWC =UV−Cosm
=UV−(Uosm×UV)÷Posm
=UV(1−Uosm/Posm)
となる。
通常は原尿は尿細管で再吸収されて濃縮尿になるため −0.5ml/min以下が正常とされる。
そのため、例えば自由水クリアランスがプラスになれば尿の溶質を等張尿で排泄した時より多くの尿が出ていることになる。
しかし、尿素などは細胞膜を介して自由に移動するし、浸透圧物質は均等には動いてはくれない。そのため、張度の概念を用いてNaとKを主に用いてFWCを表したものがEFWCとなる。そうすれば均一な動きをすると考えられる。
EFWC = UV(1−尿張度/血漿張度)になる。
= UV[1−(UNa+UK)/PNa]
となる。
これにより色々なことがわかってくる。
腎臓は細かな計算が多いが、少しでも理論的に物事を考えられるようになりたい。
腎臓でどのくらいfree waterを排出していることを知ることは、低ナトリウム血症の治療予測や高ナトリウム血症の治療計画に有用である。
尿中の全溶質が排出されるのに必要な分時あたりの血漿量を浸透圧クリアランス(Cosm)という。
Cosm(ml/min)=(Uosm×UV)÷Posm となる。
※ Uosm:尿中浸透圧、UV:尿量、Posm:血漿浸透圧である。
FWCを考えるときにわかりやすいのは、尿を溶質の部分と自由水(free water)の部分に分けるとわかりやすい。
つまり尿量と浸透圧クリアランスの差が溶質を含まないFWCになる。
FWC =UV−Cosm
=UV−(Uosm×UV)÷Posm
=UV(1−Uosm/Posm)
となる。
通常は原尿は尿細管で再吸収されて濃縮尿になるため −0.5ml/min以下が正常とされる。
そのため、例えば自由水クリアランスがプラスになれば尿の溶質を等張尿で排泄した時より多くの尿が出ていることになる。
しかし、尿素などは細胞膜を介して自由に移動するし、浸透圧物質は均等には動いてはくれない。そのため、張度の概念を用いてNaとKを主に用いてFWCを表したものがEFWCとなる。そうすれば均一な動きをすると考えられる。
EFWC = UV(1−尿張度/血漿張度)になる。
= UV[1−(UNa+UK)/PNa]
となる。
これにより色々なことがわかってくる。
腎臓は細かな計算が多いが、少しでも理論的に物事を考えられるようになりたい。
2016/10/26
ループス腎炎の未来を見据えて
病院によっては膠原病科もしくは腎臓内科が対応する疾患にループス腎炎がある。
今回JASNにループス腎炎の未来の治療の論文が出ていたので簡単に共有できればと思う。
まず、ループス腎炎に関しては有名なガイドラインが2012年のACRのガイドラインがある。また、2015年のNDTの論文では各ガイドラインに置ける比較を論文として出している。
どちらも一読の価値はある。
ループス腎炎はステロイドが発見されるまでは、5年生存率が17%であった。
ステロイドにより5年生存率が55%に上昇し、その後免疫抑制剤の登場で5年生存率が80%に上昇したと言われている。
ただ、この30年は治療は足踏み状態ではないかと言われている。
現在のスタンダード治療(induction therapy)は下記のようになっている。
このinduction therapyもいろいろな研究がされて成り立っている。ELNT(NIHのサイクロフォスファミドと低用量のサイクロフォスファミドの比較、あまり差はない)、ALMS(サイクロフォスファミドとMMFの比較、3年の長期で見るとサイクロフォスファミドがいい)
また、維持療法に関しても通常3−6ヶ月行う。再発率などを比較している研究は多い。
今回の論文で興味を惹かれたのは、この足踏みの30年でそれを打開するために様々な薬がtrialで進んでおり、特に免疫系統でB cellを抑えるもの(Rituximab、Ocrezulimab、Obinutuzumab、Atacicept、Belimumab)やPlasma cellを抑えるもの(proteasome inhibitor)など色々と開発が進んでるとのことであった。
ループス腎炎は現在でも末期腎不全になり、若年で透析依存になってしまう疾患の1つであり、少しでもそれが打開されればと切に願う。
薬物中毒について考える(各論):リチウム中毒について
では、今回は各論のリチウムについて記載する。
リチウムは主に双極性障害に用いられる治療薬で、気分の波を抑える作用を持つ薬で有名である。今回はこのリチウムをたくさん飲んだ時の中毒についてお話をしようと思う。
まず、リチウムに関しては腎臓に対してはどんな影響があるのだろう?
①腎性尿崩症の原因になる(20-40%)
②尿細管アシドーシスの原因(type1 acidosisの原因に)
③ネフローゼ症候群(微小変化群が治療開始後1.5-10ヶ月で起こりうる)
④慢性間質性腎炎(軽度から中等度タンパク尿と慢性腎機能障害を起こす)
⑤高カルシウム血症(カルシウムの細胞膜貫通の阻害、PTH分泌上昇)
が言われている。
話を中毒に戻すと薬物中毒の総論でも述べたように、透析を考える際には①タンパク結合率、②薬剤の分布容積、③分子量が重要となる。
今回、「リチウム製剤をたくさん飲んだ人がいます。透析を回してくれませんか?」と言われたとする。
まず、上記3点は確認する。①タンパク結合率:ほとんど結合しない。②薬剤の分布:0.7-0.9L/kgで低い。③分子量は7ダルトンの小分子の陽イオンである。
ここから考えると血液透析は効果が良さそうである。ただ、やはり常に透析の効果がある=透析をやるではいけない。患者さんが元気であれば行う必要はないかもしれない。
リチウム中毒は急性、慢性的に飲んでいる人の急性発症、慢性に分かれる。
症状自体(不整脈:致死的なものは稀でQT延長、消化器症状:嘔吐・下痢、神経・精神:昏迷、錯乱、ミオクローヌスなど)は大きな差はないが、慢性では腎性尿崩症、腎機能障害、内分泌障害が生じやすい。
リチウムの治療の治療域の血中濃度は0.8~1.2mEq/Lである。
論文や報告にもよるが、血中濃度が6mEq/L以上であれば透析を推奨、2.5~4mEq/Lであれば重度の神経症状、腎不全や不安定な血行動態であれば透析を推奨となっている。
ただ、問題点としては血中濃度はすぐにはわからないことである。なので、血中濃度は参考にせず始めてしまうことが多い。
また、常に透析を終わった後のリバウンドは考える必要がある。これは細胞内から出てくるためである。
リチウム中毒ではAGが陰性になることがある。これはリチウム中毒により陽イオン増加によるものである。他にAGが陰性になるものとしてはHAMBLEと覚えるといい。
HA(hypo albuminemia):低アルブミン血症
M(myeloma):多発性骨髄腫
B(Bromide):臭素
L(Lithium):リチウム
その他に高カルシウムや高マグネシウム血症も原因になる。
やはり、このようなに中毒の治療や原理を考えながら診療に当たれるのは腎臓内科の醍醐味なのかもしれないと思う今日この頃である。
リチウムは主に双極性障害に用いられる治療薬で、気分の波を抑える作用を持つ薬で有名である。今回はこのリチウムをたくさん飲んだ時の中毒についてお話をしようと思う。
まず、リチウムに関しては腎臓に対してはどんな影響があるのだろう?
①腎性尿崩症の原因になる(20-40%)
②尿細管アシドーシスの原因(type1 acidosisの原因に)
③ネフローゼ症候群(微小変化群が治療開始後1.5-10ヶ月で起こりうる)
④慢性間質性腎炎(軽度から中等度タンパク尿と慢性腎機能障害を起こす)
⑤高カルシウム血症(カルシウムの細胞膜貫通の阻害、PTH分泌上昇)
が言われている。
話を中毒に戻すと薬物中毒の総論でも述べたように、透析を考える際には①タンパク結合率、②薬剤の分布容積、③分子量が重要となる。
今回、「リチウム製剤をたくさん飲んだ人がいます。透析を回してくれませんか?」と言われたとする。
まず、上記3点は確認する。①タンパク結合率:ほとんど結合しない。②薬剤の分布:0.7-0.9L/kgで低い。③分子量は7ダルトンの小分子の陽イオンである。
ここから考えると血液透析は効果が良さそうである。ただ、やはり常に透析の効果がある=透析をやるではいけない。患者さんが元気であれば行う必要はないかもしれない。
リチウム中毒は急性、慢性的に飲んでいる人の急性発症、慢性に分かれる。
症状自体(不整脈:致死的なものは稀でQT延長、消化器症状:嘔吐・下痢、神経・精神:昏迷、錯乱、ミオクローヌスなど)は大きな差はないが、慢性では腎性尿崩症、腎機能障害、内分泌障害が生じやすい。
リチウムの治療の治療域の血中濃度は0.8~1.2mEq/Lである。
論文や報告にもよるが、血中濃度が6mEq/L以上であれば透析を推奨、2.5~4mEq/Lであれば重度の神経症状、腎不全や不安定な血行動態であれば透析を推奨となっている。
ただ、問題点としては血中濃度はすぐにはわからないことである。なので、血中濃度は参考にせず始めてしまうことが多い。
また、常に透析を終わった後のリバウンドは考える必要がある。これは細胞内から出てくるためである。
リチウム中毒ではAGが陰性になることがある。これはリチウム中毒により陽イオン増加によるものである。他にAGが陰性になるものとしてはHAMBLEと覚えるといい。
HA(hypo albuminemia):低アルブミン血症
M(myeloma):多発性骨髄腫
B(Bromide):臭素
L(Lithium):リチウム
その他に高カルシウムや高マグネシウム血症も原因になる。
やはり、このようなに中毒の治療や原理を考えながら診療に当たれるのは腎臓内科の醍醐味なのかもしれないと思う今日この頃である。
2016/10/25
薬物中毒について考えてみる(総論)
今日は少し中毒に関して触れてみたいです。
中毒は腎臓内科にとって必要な知識です。
急に集中治療領域に薬物中毒で入院した人に透析をやってくれない?と言われて、しっかりと状況の判断ややる適応があるのかを考えることは非常に重要です。
透析をやるということは、患者さんに透析カテーテルを留置しなくてはならないし、それに付随する合併症も危惧しなくてはならない。なので、必要であればやる!必要ならやらない重要な判断になります。
中毒に関しては透析を考える上で重要な項目が3つあります。
中毒は腎臓内科にとって必要な知識です。
急に集中治療領域に薬物中毒で入院した人に透析をやってくれない?と言われて、しっかりと状況の判断ややる適応があるのかを考えることは非常に重要です。
透析をやるということは、患者さんに透析カテーテルを留置しなくてはならないし、それに付随する合併症も危惧しなくてはならない。なので、必要であればやる!必要ならやらない重要な判断になります。
中毒に関しては透析を考える上で重要な項目が3つあります。
1つが「分布容積」です。分布容積は低いもののほうが除去に向いています。つまり、組織よりも血液や細胞外液に分布しやすいものには有効です。
分布容積は[血中濃度]分の[体重当たりの体内の薬物総量]です。均等に分布していれば1です。血液に多く分布していれば相対的に分母が大きくなるから、1より小さくなります。
分布容積が1より小さいものには血液浄化法が有効な可能性があります。
逆に、分布容積が1より大きく、血液の方にあまり分布していなければ意味がないです。
半減期があまり短くても意味がありません。血液浄化法は数時間かけて実施されます。極端に言えば、半減期が数分なものを何時間もかけてやっても意味がありません。
中毒で用いる血液透析方法は血液吸着法と血液透析法があります。
血液吸着法で用いられているカラムの中には先ほど出てきた活性炭がビーズ状になって詰まっています。活性炭が吸着剤で、薬毒物が吸着されて血液はきれいになります。
2つ目はたんぱく結合率です。
たんぱく質に結合している薬や毒物でも吸着剤と接触するとはぎ取られます。
血液吸着法の場合は分子量やたんぱく結合率の影響をあまり受けません。たんぱく結合率が95%以内であればだいたい大丈夫と言われています。分子量の影響を受けず、半減期がある程度長くて、分布容積が小さくてより血液や細胞外液に分布しているものが有効です。国際的に適応があるとされているのは、カルバマゼピン、フェノバルビタール、フェニトリン、テオフィリンです。
血液透析法は血液吸着と異なりタンパク結合率の影響を受けます。剥ぎ取れないので。
3つ目は分子量が小さい、1000ダルトン未満の物質です。
国際的に適応があるとされているのは、メタノール、エチレングリコール、アスピリン、リチウムです。いずれも分子量が小さく、半減期はある程度長い。分布容積は小さくて、タンパク結合率はほとんどのものがゼロです。活性炭に吸着されないものがほとんどです。
中毒に関しては
覚え方として「青魚入りのキャット・ミール(CAT-MEAL)で血がサラサラ(浄化)」と覚えるといいです。
血液吸着法の適応がある薬毒物は「CAT」で覚えます。
「C」はカルバマゼピン、
「A」は抗けいれん薬(anticonvulsants)です。フェノバルビタール、フェニトリンです。カルバマゼピンも含まれます。
「T」はテオフィリンです。
Cの中にカフェインも書いていますが、これはあまり今のところ文献的なエビデンスはありません。しかしながら、テオフィリンとカフェインは同じキサンチン誘導体で、構造式も薬物動態もとても似ています。カフェインも恐らく効くだろうと考えています。
血液透析法の適応がある薬毒物は「MEAL」で覚えます。「M」はメタノール、「E」はエチレングリコール、「A」はアスピリン、「L」はリチウムです。
今回リチウム中毒について書こうと思ったら、総論で終わっていましました。。
腎臓内科は本当に幅広い領域をカバーしますね。本当に楽しい分野だと思いますが、日々勉強ですね。。。
下記は熊本大学の資料を添付させていただいてます。とてもわかりやすいです。
HA:血液吸着、HD:血液透析です。
IgA1プロテアーゼ
IgM結合タンパクであるAIMのネコホモログをマウスに強制発現させた虚血後再潅流AKIモデルに、遺伝子組み換えでつくったマウスホモログを注射すると腎機能が回復した、などの研究をのせた論文(doi:10.1038/srep35251)が新聞やニュースで取り上げられる。それくらい、腎不全の治療をみんなが待ち望んでいる。
外来でも入院でも「先生、腎臓を治す薬ってのはないんですね?」とおっしゃる患者さんたちにはいつも申し訳ないと思っている(日本版バルドキソロンがどうなるか)。アメリカのTVシリーズ『スター・トレック』では腎臓病がなおる未来からきたDr. McCoyが透析患者さんに薬をあげるシーンがある(おばあさんが、The doctor gave me a pill and I grew a new kidney!と喜ぶ、写真)し、不可能を可能にするプロジェクトにお金を出すXPRIZE財団も腎臓病研究をリストに入れている。
そんなわけで今月のJASNに載ったIgA1プロテアーゼの研究結果(JASN 2016 27 2622)が、次につながればいいなと思っている。ヒトのIgA1と受容体の可溶性CD89をマウスに強制発現させたモデルではある。IgA1プロテアーゼというのは細菌由来のいわば毒で、マウスはいいがヒトではさまざまな免疫反応を惹起するらしい(BMC 2007 7113)。
それでもIgA1プロテアーゼはメザンギウムにおける免疫複合体を一旦は消失させるんだから、方法論としては合っているんじゃないかと思う。この先が分子エンジニアリングで毒性を落としたプロテアーゼなのか、抗IgA1ヒンジ部モノクローナル抗体なのか、GALT/NALTに関わりIgAを減らす治療なのかはわからないけれど。
外来でも入院でも「先生、腎臓を治す薬ってのはないんですね?」とおっしゃる患者さんたちにはいつも申し訳ないと思っている(日本版バルドキソロンがどうなるか)。アメリカのTVシリーズ『スター・トレック』では腎臓病がなおる未来からきたDr. McCoyが透析患者さんに薬をあげるシーンがある(おばあさんが、The doctor gave me a pill and I grew a new kidney!と喜ぶ、写真)し、不可能を可能にするプロジェクトにお金を出すXPRIZE財団も腎臓病研究をリストに入れている。
そんなわけで今月のJASNに載ったIgA1プロテアーゼの研究結果(JASN 2016 27 2622)が、次につながればいいなと思っている。ヒトのIgA1と受容体の可溶性CD89をマウスに強制発現させたモデルではある。IgA1プロテアーゼというのは細菌由来のいわば毒で、マウスはいいがヒトではさまざまな免疫反応を惹起するらしい(BMC 2007 7113)。
それでもIgA1プロテアーゼはメザンギウムにおける免疫複合体を一旦は消失させるんだから、方法論としては合っているんじゃないかと思う。この先が分子エンジニアリングで毒性を落としたプロテアーゼなのか、抗IgA1ヒンジ部モノクローナル抗体なのか、GALT/NALTに関わりIgAを減らす治療なのかはわからないけれど。
薄切り肉を圧力鍋で茹でる
東洋医学で医食同源とか身土不二(신토불이、シントブリ)とかいうし、西洋はyou are what you eatとか言うけれども、腎臓内科ほど栄養・食事と深く関わる科もそうないのかなと思う。なかでもリンは、透析であまり除けないのに多くの食品に入っているので、その人ごとにあわせた工夫が必要だ(最近は大手コンビニでもパンや加工食品のリンを減らしているところがある)。
それで腎臓系で栄養系の雑誌というのもたくさんあって、以前に肉をさまざまな方法で調理することでリン残量が変わるかをみた論文(J of Renal Nutrition 2015 25 504)があった。結果、薄切りした肉を圧力鍋で茹でるとリンがもっとも落ちたという。煮汁は捨てなければならないだろうから、どう味を保つかは別問題だが(フルで論文を読めば提案してあるかもしれない)。
なお、これは日本の研究だ。見なくてもわかる。薄切り生肉は東アジアの食文化だと思われるからだ。米国のスーパーや肉屋にいっても薄切りした生肉はみない(ハムなどの塩漬け肉、ローストビーフのような調理済みの肉は除く)。東アジア食材店にいけば、ある。どうしてだろう。
2016/10/23
食品添加物の重要性
当たり前かもしれないが腎臓内科医にとってリンはとっても大切である。
特に慢性腎不全にとってリンの管理は重要なことである。医師は薬を使ってリンを下げようとするが食事の管理は本当に重要である。
リンの食事で現代社会では食品添加物が重要な問題である。今回この論文では末期腎不全患者に食品添加物を制限した群(67人)とコントロール群(63人)でRCTを組んでいる。
結果では当初は血清リン値に違いはでなかったが、3ヶ月であれば有意差を持ち制限群での血清リンの低下を認め、70%近くが血清リンが5.5mg/dl以下になったということである。
2009年のJAMAにも同じような結果が出ている(これもRCTで人数は今回のものより大きい)
これに関しては僕たちが教科書的なものから得る知識であり、実際にこのように示されてわかることは、食品添加物の制限は重要であること・また、制限して3ヶ月程度して結果として出てくることである。
自分の目の前の患者さんに制限の重要性を話した時、「数ヶ月で血清リン低下の結果が出てきますから頑張りましょうね」というと少し目標が見えていいのかもしれない。
しかし、自分の知識がないので調べてみたのだが食品添加物(特に今回はリン酸塩)はなぜ必要なのか?
リン酸塩はまず大きく二つに分かれオルトリン酸塩、重合リン酸塩に分かれます。
リン酸塩はカマボコのコシを強くしたり、ハム・ソーセージの保水性・粘着性・膨張性を増したり、練り物・缶詰・醤油・佃煮・ソース・漬物・豆腐・アイスクリーム・酒類・チーズ・中華麺なでの変色防止や風味の工場など広い効果を持ちます。
つまりリン酸塩によって、加工食品の弾力UP、色調改善、保水性UPさせているようです。
リンの過剰摂取はPTH上昇をきたし、リン排泄を促すのと同時に骨粗鬆症もきたすためリンの管理は非常に重要である。
その中で、今回はリンの食品添加物との関連について簡単に書かせていただいた。
ただ、美味しそうというものにはおそらくリンが含まれているんだろうと思うし、自分たちがしっかりと知識をつけて患者さんに教育していくことは重要であると感じる。
2016/10/10
アミロイドーシスについて
今回アミロイドーシスを書こうと思ったのは単純にアミロイドーシスを診療していて、よくわかってないなと思ったのがきっかけである。
アミロイドって自分の身近になくイメージがつかみにくく、イメージがつかみにくいから病気もつかみにくいのかなと思ったので復習もかねて書こうと思った。
・アミロイドとは・・
以前はヨウ素デンプン反応と似た反応をすることからデンプン(ラテン語でamylum)と関係があると思ってつけられたものであるが、本体はある種のタンパク質である。
タンパク質は産生されると特定の形に折りたたまれる(フォールディング)が、この折りたたみの異常(加齢や慢性炎症や遺伝など)が生じると、異常なタンパク質が生じ、異常なものは除去される。
しかし、異常なたんぱく質ができるのが多すぎたりすると除去しきれず疾患の発症につながる。これがアミロイド-シスの根本である。
・歴史:19世紀から知られているが、理解が深まったのはここ数十年といわれている。
アミロイドーシスはまれな疾患であるが、一つには我々の認知不足もあるのかもしれない。そのためにこの疾患の理解を深め、しっかりと患者をみれるようになりたい。
・アミロイドの頭文字:
アミロイドは上にAAやALなどの頭文字がついているが、これは最初のA:アミロイドを意味し、次のAAのAは血性アミロイドA、ALのLはL鎖抗体由来アミロイドを指す。ATTRはトランスサイレチン由来のアミロイドを示す(下図参照)。
図:全身性アミロイドーシスの分類
・アミロイドーシス:
アミロイドタンパク質は血流に蓄積するため、最終的に臓器や組織に沈着する。結果として生まれるアミロイド線維が、多臓器の障害を引き起こしたり、体内の一部位に局在したりする可能性がある。アミロイドは通常、腎臓、心臓、神経に沈着し、時には肝臓、脾臓、消化管や気道に影響を及ぼすこともある。
全身に沈着するものを全身性アミロイドーシス、特定臓器に沈着するものを限局性アミロイドーシスと呼ぶ。
今回は簡単にAAとALについて述べる。
私が混乱するのはおそらくはどのように産生されるか、疾患をどのように考えるかがわかっていなかったのが一番であると思う。読者の中にはそのような方もいると思うので、少しでも参考になればありがたい。
どこでできる?:ALの前駆蛋白は骨髄で産生されるもので、AAは循環血中の炎症性蛋白であり血中で産生されることが大きく異なる。
→
・ALでは多発性骨髄腫や原発性マクログロブリン血症を探すための検査(SPEP,UPEPや骨髄穿刺・生検)をする必要がある。
・AAでは血中でできるので基礎となる炎症を惹起する関節リウマチ、血管炎、Castleman病、自己免疫疾患などを精査する必要がある。
・診断:臨床症状や所見から疑い、組織で光顕でCongo-red染色陽性や電顕でのアミロイド繊維を見つけることである。AAとALは過マンガン酸処理でALは染色性が消失し、AAでは染色性が保たれる特徴を持つ。ただ、ALでも陽性になることがあり、診断には悩むことが多い。DFS染色なども有効とは言われる。
しかし、どの型なんだろうと悩むことは大いにある。そのような症例に当たった際には、病型診断を手助けするために信州大学(支援サービス)や熊本大学(支援サービス)があるので、利用するといいと思う。
今回は論文的なことではなく、自分の復習と情報整理を中心に書かせていただいた。
我々にとってアミロイドーシスは目には見えない疾患であり、多臓器が侵されてくる場合もあり、腎臓内科医として総合的な判断が必要になってくる疾患である。
2016/10/02
IgA腎症の治療って2(扁桃摘出パルスに関して)
前回IgA腎症の治療について書いてみた。
今日は日本で主に行われているIgA腎症に対する扁桃摘出パルス療法について考えてみた。
まず、日本ではアンケート調査で扁桃摘出または扁桃摘出+ステロイドパルス併用療法は65%以上で使用されている。おそらくは扁桃摘出の有効性を実感しているためこんなに高い数字なのであろう。
では、なぜ効くのか?を考えた時にIgA腎症の原因などの病態を把握する必要がある。
IgA腎症はIgAの特にIgA1サブタイプのヒンジ部糖鎖修飾異常(糖鎖異常IgA:GdIgA1(がラクトース欠損IgA1))が増加し、それに対する抗体の産生→免疫複合体の形成し、メサンギウム領域への沈着が生じるmulti hit 仮説が提言されている(JASN 2011 22(10) 1795-1803)。
面白いこととしては、GdIgA1を利用してそれによってIgA腎症を診断しようとする報告がいなされている(PLos One 2014 May 23;9(5))。これが現実化することでの利点としてはアジアの地域に多いIgA腎症を早期に診断することができるという点である。
IgA腎症の診断には腎生検が必要となるが、発展途上国ではそれも満足に行えない地域もあり、採血や尿マーカーで診断がつく時代が来れば個人的には嬉しい。また、後でも述べるがIgA腎症は早期の診断早期治療が大切なので、本当に重要であると感じる。
では、どの粘膜B細胞が作成しているかであるが、注目されているのがGALT(gut-associated lymphoid tissue:腸管関連リンパ組織)、NALT(nasopharynx-associated lymphoid tissue:鼻咽頭関連リンパ組織)である。
GALTに注目したのが、先のNEFIGAN TrialでのNefecon(腸管選択的ステロイド)である。
二つの違いはIgAサブタイプの偏りがありIgA1はNALTに多く発現している。
また、NALTは骨髄との関連がありIgA腎症の発症はMucosa-Bone Marrow Axisの異常が生じているためと考えられている。骨髄に関してはAPRILが話題であり、これの増加がIgA腎症の予後を悪くしているという報告もあり、(Medicine Volume 95, Number 11, March 2016)、これを多く持つものに対して扁桃摘出を行ったほうが効果があるという報告もある。
扁桃摘出パルスに関しては、先日扁桃摘出パルスの元祖の堀田修先生(現在はクリニックを仙台で開業されている)のお話を聞くことができた。簡単にまとめるとやはり大切なのは早期診断、早期治療ということであった。
IgA腎症を血尿主体の時の糸球体腎炎のphaseとそれ以降の蛋白尿が主体になる二次性FSGSのphaseに分けて話してくださった。二次性FSGSの状態ではいわゆる糸球体が焼け跡になってしまっているので、扁桃摘出パルスをしても効果に乏しいというお話を聞き、なるほど理にかなっているなと感じた。焼け跡になってしまってからでは遅いので、糸球体血管炎の早期の時期からの治療開始を推奨していた。ただ、この時期は血尿だけの時期なので日本のガイドライン上も経過観察となっている部分ではあり、患者さんにこのような治療の選択肢を行い納得いただけるようなら行うのもひとつかなと感じた。また、堀田先生のクリニックでは扁桃摘出パルスの他にも鼻咽腔の部分の処置を行ったりなど、本当に全てを前向きに動かれる姿勢の凄さ、考え方の凄さに本当に感銘を受けた。
・扁桃摘出パルスに関しては扁桃摘出とパルス療法はどちらが先でもいいらしいが、扁桃摘出を先行した場合はパルス投与を扁桃摘出から7日後以降に行うとのことであった。また、パルスを先行した場合には6ヶ月以内に扁桃摘出を行うのが原則のようである。
・実際に扁桃摘出パルスは論文などはどうかではあるか
日本では厚労省進行性腎疾患に関する調査研究班・IgA腎症分化会が主体となって行ったランダム化比較試験(RCT)「IgA腎症に対する扁桃摘出術とステロイドパルス療法の有効性に関する多施設共同研究」が行われており、2011年の腎臓学会で中間報告され、寛解率は扁桃摘出パルスが良かったが、尿タンパクなど明らかな有意差が出ていない。最終報告はまだなので今後の報告にこれは期待したい。
海外では中国からのメタアナリシス(Nephrol. Dial. Transplant. (2011) 26 (6): 1923-1931.)が出されている。これでは、扁桃摘出単独やパルス単独では寛解に至らなかったが、扁桃摘出パルスでは寛解に至ったと報告している。
色々と書いたが、IgA腎症はしっかりと病態を理解し、様々な選択肢から患者さんのニーズに合う治療を選択することが大事である。
今はインターネット社会であり、扁桃摘出パルスに関しても調べ上げてくる人にも出会うかもしれない。そういったときに治療の提示やメリット・デメリットが話せるような医師になりたい。
今日は日本で主に行われているIgA腎症に対する扁桃摘出パルス療法について考えてみた。
まず、日本ではアンケート調査で扁桃摘出または扁桃摘出+ステロイドパルス併用療法は65%以上で使用されている。おそらくは扁桃摘出の有効性を実感しているためこんなに高い数字なのであろう。
では、なぜ効くのか?を考えた時にIgA腎症の原因などの病態を把握する必要がある。
IgA腎症はIgAの特にIgA1サブタイプのヒンジ部糖鎖修飾異常(糖鎖異常IgA:GdIgA1(がラクトース欠損IgA1))が増加し、それに対する抗体の産生→免疫複合体の形成し、メサンギウム領域への沈着が生じるmulti hit 仮説が提言されている(JASN 2011 22(10) 1795-1803)。
面白いこととしては、GdIgA1を利用してそれによってIgA腎症を診断しようとする報告がいなされている(PLos One 2014 May 23;9(5))。これが現実化することでの利点としてはアジアの地域に多いIgA腎症を早期に診断することができるという点である。
IgA腎症の診断には腎生検が必要となるが、発展途上国ではそれも満足に行えない地域もあり、採血や尿マーカーで診断がつく時代が来れば個人的には嬉しい。また、後でも述べるがIgA腎症は早期の診断早期治療が大切なので、本当に重要であると感じる。
では、どの粘膜B細胞が作成しているかであるが、注目されているのがGALT(gut-associated lymphoid tissue:腸管関連リンパ組織)、NALT(nasopharynx-associated lymphoid tissue:鼻咽頭関連リンパ組織)である。
GALTに注目したのが、先のNEFIGAN TrialでのNefecon(腸管選択的ステロイド)である。
二つの違いはIgAサブタイプの偏りがありIgA1はNALTに多く発現している。
また、NALTは骨髄との関連がありIgA腎症の発症はMucosa-Bone Marrow Axisの異常が生じているためと考えられている。骨髄に関してはAPRILが話題であり、これの増加がIgA腎症の予後を悪くしているという報告もあり、(Medicine Volume 95, Number 11, March 2016)、これを多く持つものに対して扁桃摘出を行ったほうが効果があるという報告もある。
扁桃摘出パルスに関しては、先日扁桃摘出パルスの元祖の堀田修先生(現在はクリニックを仙台で開業されている)のお話を聞くことができた。簡単にまとめるとやはり大切なのは早期診断、早期治療ということであった。
IgA腎症を血尿主体の時の糸球体腎炎のphaseとそれ以降の蛋白尿が主体になる二次性FSGSのphaseに分けて話してくださった。二次性FSGSの状態ではいわゆる糸球体が焼け跡になってしまっているので、扁桃摘出パルスをしても効果に乏しいというお話を聞き、なるほど理にかなっているなと感じた。焼け跡になってしまってからでは遅いので、糸球体血管炎の早期の時期からの治療開始を推奨していた。ただ、この時期は血尿だけの時期なので日本のガイドライン上も経過観察となっている部分ではあり、患者さんにこのような治療の選択肢を行い納得いただけるようなら行うのもひとつかなと感じた。また、堀田先生のクリニックでは扁桃摘出パルスの他にも鼻咽腔の部分の処置を行ったりなど、本当に全てを前向きに動かれる姿勢の凄さ、考え方の凄さに本当に感銘を受けた。
・扁桃摘出パルスに関しては扁桃摘出とパルス療法はどちらが先でもいいらしいが、扁桃摘出を先行した場合はパルス投与を扁桃摘出から7日後以降に行うとのことであった。また、パルスを先行した場合には6ヶ月以内に扁桃摘出を行うのが原則のようである。
・実際に扁桃摘出パルスは論文などはどうかではあるか
日本では厚労省進行性腎疾患に関する調査研究班・IgA腎症分化会が主体となって行ったランダム化比較試験(RCT)「IgA腎症に対する扁桃摘出術とステロイドパルス療法の有効性に関する多施設共同研究」が行われており、2011年の腎臓学会で中間報告され、寛解率は扁桃摘出パルスが良かったが、尿タンパクなど明らかな有意差が出ていない。最終報告はまだなので今後の報告にこれは期待したい。
海外では中国からのメタアナリシス(
色々と書いたが、IgA腎症はしっかりと病態を理解し、様々な選択肢から患者さんのニーズに合う治療を選択することが大事である。
今はインターネット社会であり、扁桃摘出パルスに関しても調べ上げてくる人にも出会うかもしれない。そういったときに治療の提示やメリット・デメリットが話せるような医師になりたい。
2016/09/27
IgA腎症の治療って
IgA腎症の治療は2015年にSTOP-IgAN(N Engl J Med 2015;373:2225-36)がNEJMにでて色々衝撃を与えた分野である。
簡単に書くとSTOP-IgANは腎生検で診断されたIgA腎症においてACE-IやARBを用いて血圧を125/75mmHg未満にするなどの支持療法を6ヶ月しても蛋白尿≧0.75g/day以上の症例を対象としたRCTである。
支持療法群と免疫抑制療法併用群と比較している。免疫抑制療法群に関してはeGFRの値(60未満と以上)で異なる治療を行っている。
結果としては明らかな有意差はなく、ステロイド使用群で副作用でステロイド性糖尿病や体重増加のリスクが増加し感染症のリスクが増加した。
つまり、この群(蛋白尿≧0.75g/day以上)でも支持療法しましょうというものであった。
今回、JASNで[Corticosteroids in IgA Nephropathy: Lessons from Recent Studies]というbrief review(doi: 10.1681/ASN.2016060647)があり、よくまとまっていた。
現在のIgANの治療はKDIGO ガイドライン(KDIGO 2012)では
血圧コントロールは, ACE阻害薬やARBで行い,蛋白尿 <1g/dでは<130/80mmHgを目標、
蛋白尿 >1g/dでは<125/75mmHgを目標としましょう!
免疫抑制療法に関しては:3-6ヶ月のACE阻害薬やARBによる治療で、蛋白尿≥1g/dの場合は免疫抑制療法を行いましょう。免疫抑制療法はステロイドを主に使用しましょう
(Pozzi protocol:1gステロイドパルス3回(1,3,5ヶ月目)と隔日投与のPSL0.5mg/kg、
または0.8-1mg/kgの毎日の経口ステロイド内服)となっている。
様々なスタディが免疫抑制療法はどうなのか検証されている。
VALIGA cohort trial(Kidney Int 2014; 86: 828–836)ではRAS阻害薬単独よりもRAS阻害薬+ステロイド投与が蛋白尿>1g/dayの症例にはよく、eGFR<50の症例にもいいのではと言っている。
TESTING study( (ClinicalTrials.gov no. 01560052)はIgANで蛋白尿>1g/dayの症例でeGFRが20-120までの症例を集めステロイド治療(0.8mg/kg経口で2ヶ月でその後6-8か月で減量)の効果を見ている。
この症例では副作用で1.5年で中止になっている。副作用としては感染症である。ただ、ステロイド治療によって蛋白尿の減少含めた腎機能保護には優位に働いたという結果も得られている。
その他現在様々なスタディが進んでいる(直近ではIgANの病態で消化管の免疫の関連があるのではないかということで注目が集まっている、NEFIGAN trial: ClinicalTrials.gov no. 01738035)。これらは今後の結論を待ちたい。
なので、現状のIgANの治療判断としては難しいが、自分はこの論文の作者たちと同じ意見だが、KDIGOのガイドラインがなんだかんだいってバランスは取れていると考えそれを実践している。その中で、患者の状態や年齢を含めて考え、これらのスタディを活かせていけたらなと思う。
次回は日本の扁桃摘出パルスについて触れてみたいと思う。
腎臓はやはり奥が深い。。
簡単に書くとSTOP-IgANは腎生検で診断されたIgA腎症においてACE-IやARBを用いて血圧を125/75mmHg未満にするなどの支持療法を6ヶ月しても蛋白尿≧0.75g/day以上の症例を対象としたRCTである。
支持療法群と免疫抑制療法併用群と比較している。免疫抑制療法群に関してはeGFRの値(60未満と以上)で異なる治療を行っている。
結果としては明らかな有意差はなく、ステロイド使用群で副作用でステロイド性糖尿病や体重増加のリスクが増加し感染症のリスクが増加した。
つまり、この群(蛋白尿≧0.75g/day以上)でも支持療法しましょうというものであった。
今回、JASNで[Corticosteroids in IgA Nephropathy: Lessons from Recent Studies]というbrief review(doi: 10.1681/ASN.2016060647)があり、よくまとまっていた。
現在のIgANの治療はKDIGO ガイドライン(KDIGO 2012)では
血圧コントロールは, ACE阻害薬やARBで行い,蛋白尿 <1g/dでは<130/80mmHgを目標、
蛋白尿 >1g/dでは<125/75mmHgを目標としましょう!
免疫抑制療法に関しては:3-6ヶ月のACE阻害薬やARBによる治療で、蛋白尿≥1g/dの場合は免疫抑制療法を行いましょう。免疫抑制療法はステロイドを主に使用しましょう
(Pozzi protocol:1gステロイドパルス3回(1,3,5ヶ月目)と隔日投与のPSL0.5mg/kg、
または0.8-1mg/kgの毎日の経口ステロイド内服)となっている。
様々なスタディが免疫抑制療法はどうなのか検証されている。
VALIGA cohort trial(Kidney Int 2014; 86: 828–836)ではRAS阻害薬単独よりもRAS阻害薬+ステロイド投与が蛋白尿>1g/dayの症例にはよく、eGFR<50の症例にもいいのではと言っている。
TESTING study( (ClinicalTrials.gov no. 01560052)はIgANで蛋白尿>1g/dayの症例でeGFRが20-120までの症例を集めステロイド治療(0.8mg/kg経口で2ヶ月でその後6-8か月で減量)の効果を見ている。
この症例では副作用で1.5年で中止になっている。副作用としては感染症である。ただ、ステロイド治療によって蛋白尿の減少含めた腎機能保護には優位に働いたという結果も得られている。
その他現在様々なスタディが進んでいる(直近ではIgANの病態で消化管の免疫の関連があるのではないかということで注目が集まっている、NEFIGAN trial: ClinicalTrials.gov no. 01738035)。これらは今後の結論を待ちたい。
なので、現状のIgANの治療判断としては難しいが、自分はこの論文の作者たちと同じ意見だが、KDIGOのガイドラインがなんだかんだいってバランスは取れていると考えそれを実践している。その中で、患者の状態や年齢を含めて考え、これらのスタディを活かせていけたらなと思う。
次回は日本の扁桃摘出パルスについて触れてみたいと思う。
腎臓はやはり奥が深い。。
2016/09/06
O Captain My Captain
手を動かして患者さんに管を入れたり抜いたり針を刺したり糸を縫ったりすることを「手技」というが、これは医学用語だからスマホに「しゅぎ」と話しかけても「主義」がでる。「企業会計原則」も「貸借対照表」もでるから、使用頻度の問題だろう。で、手技をあまりしないと非日常なものに感じられてくる。物品をそろえるのも場所を確保するのも一大事で、決められた時間に決められたことをやるという「お仕事感」が乏しい。しかし同じ病院の手術室やカテ室や透視室や透析室では日常的に手技手術が行われている。
米国内科専門医をとるのに必要なのは末梢静脈ルート5本、末梢静脈採血5回、動脈ガス採血5回、動脈ライン5本、Papスメアと培養提出(婦人科領域)5回だったはず。中心静脈ルートも胸腔穿刺ももちろんやるが、理解して説明できればよく必須ではない。そこには手技は手技の人に任せるという文化があるからで、よく知られているだろうがたとえば末梢静脈の採血や穿刺はphlebotomist(和訳は「瀉血専門医」だの「静脈切開する人」だの追いついてないのでフレボトミストという)がやる。
しかし、これから頭が人工知能に敵わなくなるかもしれないし、手は動かしていたい。腎臓内科なら透析カテーテル留置と腎生検に満足せず、インターベンショナル・ネフロロジー、とくにVAIVT(vascular access interventional therapy、たぶん和製英語)の世界に出て行きたい。まず末梢静脈、シャント・グラフト、動脈に穿刺ができて、ハッピーキャス®の種類に精通しないといけない(手技のデバイスは商品名でないといけない、そしてその会社の担当者さんがチームの一員としてモノを術場に出してくれる)。
そのあと、留置用透析カテーテル挿入用トンネラーだの、5Frシースだの0.035インチのホッケー型ガイドワイヤーだの、CONQUEST®バルーンカテーテルだのMUSTANG®(アメリカの野生馬の意味)バルーンカテーテルだの、インデフレーターで16atmを1分だのと言われてわかるようになる。作法も、造影剤を生理食塩水と1:1で割ったら絶対に「ヘパ生(へぱせい、ヘパリン入り生理食塩水)」と間違えないようにするとか、透視室に入る時には透視を出していない時でも必ず放射線防護の服、甲状腺プロテクタ、水晶体プロテクタをつける(いつ不意に放射線が出るかわからない)とか習う。
しかし一番だいじなのは、手技の術者は艦長や機長といっしょだということだ。とにかく離陸した以上は何があっても安全に着陸しなければならない。手術するからには手術する理由があるわけだから、困難があっても目的を達しなければならないが、目的が変わったときには臨機応変に動かなければならない。どちらも優しいスタッフの協力でやっていける(写真はドラマGOOD LUCK!で航空整備士を演じた柴咲コウさん)。唯一の違いは、機長は乗客と命を共にするが術者はしないということ(燃え尽きや針刺し事故や放射線被曝はあるが)。
2016/09/01
Canons and Apocrypha
オーストラリア、ニュージーランドはけっこう自前でスタディを組み、その結果が斬新なことが多い。こないだAJKDにでたメタアナリシスも、腎不全患者さんにおいてリン吸着剤と生命予後に「相関はない」というもの(DOI:10.1053/j.ajkd.2016.05.015、日本のスタディもはいっている)。リン吸着剤は心血管病患者さんにおける抗高脂血症薬のようなキードラッグなだけに、真逆な結果すぎてしばらくは無視されるのではないかと思う。
ただ、カルシウム含有吸着剤が非含有(セベラマーだけで、ほかはサンプル数が少ないためか有意差がなかったが)にくらべて生存率が低いという結果はほかの試験でも確認されているので、非含有の吸着剤が標準的になっていくのかなと思う。個人的には、リン値をmmol/lからmg/dlに変えるときには3.095975倍すればいいというのが発見だった。
ガイドラインは質の高くないスタディが根拠なこともおおいが、載れば正典だ。ただ載らない外典にも、ある患者層には役立つのかもしれない。たとえば、毎食前に飲まなければないリン吸着剤を1回にしてみても、結構な人たちでリン値がかわらなかったというスタディがある(AJKD 2006 48 437、対象はセベラマー内服の白人とアフリカ系透析患者、平均年齢は72歳)。
ただ、カルシウム含有吸着剤が非含有(セベラマーだけで、ほかはサンプル数が少ないためか有意差がなかったが)にくらべて生存率が低いという結果はほかの試験でも確認されているので、非含有の吸着剤が標準的になっていくのかなと思う。個人的には、リン値をmmol/lからmg/dlに変えるときには3.095975倍すればいいというのが発見だった。
ガイドラインは質の高くないスタディが根拠なこともおおいが、載れば正典だ。ただ載らない外典にも、ある患者層には役立つのかもしれない。たとえば、毎食前に飲まなければないリン吸着剤を1回にしてみても、結構な人たちでリン値がかわらなかったというスタディがある(AJKD 2006 48 437、対象はセベラマー内服の白人とアフリカ系透析患者、平均年齢は72歳)。
登録:
投稿 (Atom)