診療していて悩むのは、
①糖尿病性腎症末期のタンパク尿が減らない。。どうしよう。
②activeな腎炎がない時にこのタンパク尿を放置していいのか?放置した場合になにか悪いのか?
などを悩むことが多い。。
そもそもタンパク尿の程度は直接的な糸球体内圧の変化によって変動すると言われている。なので、我々としては糸球体内圧を減らす治療→タンパク尿の減少につながると考えて治療を行なっている。
①に関しては、糖尿病患者に対するタンパク尿の軽減がどこまでの有効性をもたらすかは不明確な部分が多かった。
1994年の論文では、1型糖尿病の研究であるが、ネフローゼレベルのタンパク尿が出ている症例に対して、タンパク尿を抑えた群は、腎機能悪化の予防と良好な血圧コントロールに繋がったことを示した。
その後にIDNtrialやRENAAL trialのpotshot analysisなどでもタンパク尿の減少→腎予後の改善に繋がっていることを示している。
では、タンパク尿を減らすために我々ができることは下記の方法がある。
①ACE-I や ARB単剤の使用
②ACE-I+ARBの使用
③ARB+直接レニン阻害薬の使用
④選択的ミネラルコルチコイド拮抗薬の使用
⑤他の降圧薬の併用療法
⑥塩分コントロール
(+αでペントキシフィリンなど)
①に関しては、下図に示すようにACE-IやARBの使用がタンパク尿の軽減に寄与することが示されている。
また、先に述べたIDN trial(irbesartan:アバプロ)やRENAAL trial(losartan:ニューロタン)でも示されている。
②に関しては、知っておくべきtrialはVA NEPHRON-D studyとONTARGET trialである。
結論だけに割愛するが、両方とも併用療法を行い、腎不全や死亡率の点で単剤治療と差は認めなかったが、急性腎不全、低血圧や高カリウム血症の割合は併用療法で増加したことがわかっている。
併用療法は推奨度は低いと考える。
③ARB+直接レニン阻害薬(ラジレス)である。
これに関してはAVOID trialで有効性が示されている。ラジレス+ニューロタンの使用で20%以上タンパク尿を低下させた。その際に合併症なども見られることがなかったという。
しかし、その後のALTITUDE trialで腎機能の保持には働かず、また合併症が優位に多かったという報告がされている。
なので、これも現時点では推奨度は低い。
④選択的ミネラルコルチコイド拮抗薬(セララ)の使用に関しては、長期データに関してはないものの単剤でもタンパク尿を減らしたというデータもあり、またACE-IやARBと併用することでタンパク尿を減らし、腎保護に働かせたというデータも散見されている。
腎機能がある程度維持されているケースに用いているので、高カリウム血症や腎機能が低下した例では注意をする必要がある。
これに関しては、ケースを選べば推奨度は中等度。
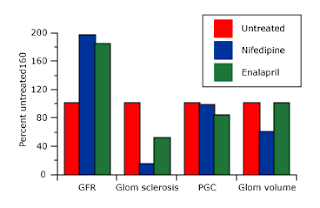
⑤他の降圧薬との併用療法では、非ジヒドロピリジン形カルシウム拮抗薬(diltiazem:ヘルベッサー、verapamil:ワソラン)は単剤使用でもタンパク尿の減少をもたらしたという報告もあり、併用でも同様な結果が下図のように示されている。
色々な機序がいわれているが、マウスの研究では糸球体内圧の低下をもたらし改善させているといわれている。
ジヒドロピリジン系のカルシウム拮抗薬(amlodipine:アムロジン、nefedipine:アダラートなど)はタンパク尿を増やしたという報告もあれば、変化させないという報告もある。
推奨度は中等度。
⑥塩分制限に関しては、研究は少ないが4g/day未満に塩分摂取を抑えた場合にARBに夜タンパク尿低下作用がしっかりと出たという報告がある。4g/日というと厳しすぎるが、塩分制限が重要であるということは抑えておく必要がある。
推奨度は中等度〜高度
今回振り返って見て、タンパク尿を減らすという意味で我々ができることはやはり少ないなと感じる。
ただ、本当にタンパク尿低下→腎機能悪化予防なのか?ここを次回は少し触れたいないと思う。