我々も患者の治療を続けるとともに、感染を広げないように一人一人が気をつけていかなくてはならない。
今回は、透析患者とCOVID-19に関しての話をしていこうと思う。わかりやすいようにQ&A形式で進めていきたい。
■透析患者におけるCOVID-19の感染後の死亡リスク?
COVID-19感染で死亡リスクが高くなるものとして高齢者、心血管疾患、糖尿病、慢性呼吸器疾患、高血圧、悪性腫瘍が言われている(BMJ 2020)。透析患者では、高齢であったり、様々な合併症を抱えている場合も多く死亡リスクは高くなる。ただ、血液透析患者では旅行に行く機会が限られるし、その点では感染暴露の機会は少ないと考えられているが、いったん血液透析センターに感染がひろがった場合には非常に大変である。やはり密集しているセンターのことが多いためである。
その場合に、本邦の一部の医師も言っているが、施設血液透析患者を流行時には腹膜透析や在宅血液透析に一時的にすることで、透析室内の爆発的な感染の際に防ぐということも必要な選択肢なのかもしれない。在宅血液透析に急に移行することは現実的に難しいので、腹膜透析を一時的にBridgeすることは一つの方法なのかと考えられる(除水を目的に10%ブドウ糖の腹膜透析が有効という報告も有る)。また、末期腎不全患者の腎代替療法治療の選択で、今は腹膜透析や在宅血液透析を推奨するのはいいのかもしれない。
ただ、やはり予防をするということが一番大事!予防という点で、一つはDavitaの動画と透析医会から出ている情報は有用なので参照していただきたい。
■透析患者に透析センターでない外で気をつけるようにいうことは?
これに関しては、上の動画と重複はしてしまうが、
・なるべく透析を受けていない時以外は家にいてください。
・可能であれば透析センターに来る際に、公共交通機関を避けて、個人の交通手段を用いてください。
・子供や孫との接触は避けるようにしてください。若い人が無症状にCOVID-19を保有している事があるので注意してください。
・家族内での感染を注意してください(透析患者の家族は体温を1日に1回測定したり、手洗いやうがいをしたりする。)
■透析センターで一般的な衛生管理の方法は?
これは、上に記載した透析医会から出ている情報の資料が写真もついていて、とても理解しやすい。下に別の図も添付するが、
・患者の部屋や待合室にアルコール消毒をし、患者にも使用してもらうように促す。
・患者には透析前に手とシャント部分も洗ってもらうように推奨する。
・看護師や医療スタッフは、透析室にいるときは外科用マスクをつけ、眼鏡もつける。また、石鹸で手を洗いアルコール消毒も行う。
・もし、小児と大人の透析室が分断されていない環境であればしっかりと分断をして管理する。
ここまでをまとめると、まずは予防が非常に重要になる。
とくに、透析室の中は密集しているところも多くパンデミックになりやすい。
しっかりと指導をして医療従事者も感染を起こさないということが非常に重要となってくる。下の図は非常にわかりやすいので是非参考にしていただきたい。
■もし、自分の透析患者さんがCOVID-19に疑わしい症状がある場合には?
・COVID-19の検査を行う。
・部屋を分けて隔離をする。
・同じ透析の部屋で、COVID-19を疑わない患者と透析をする場合には、隔離部屋を可能であれば使用する。
・隔離部屋がない場合には、一日の最後に透析をするなど他の患者への暴露を最小限にするように努力する。
■疑わしい患者の検査をどうするか?
これは、海外のものと本邦では少し違うかもしれない。
・海外では、しっかり個人の感染防御(マスク・ガウン・ゴーグル)を行い、さらにセーフガードを用いて鼻咽頭からの検査を、忙しい救急外来に送らずに、自分の部署で行うとしている。
・本邦では透析患者における、COVID-19 の帰国者・接触者相談センターへの相談の目安は、感冒症状や 37.5℃以上の発熱が 2 日程度続く場合、強い倦怠感や呼吸困難がある場合とされている
なので、疑わしい患者は、次回の透析受診前に電話連絡を行うように指示して、上記の症状に合致する場合は、帰国者・接触者相談センターに、基本的に患者より連絡する。COVID-19 の疑いがある場合には、「帰国者・接触者外来」を設置している医療機関が案内される。もちろん、大きな病院(検査が自施設で可能な病院)はこの限りではない。
■今、研究段階の薬を透析患者に使用することはどうか?
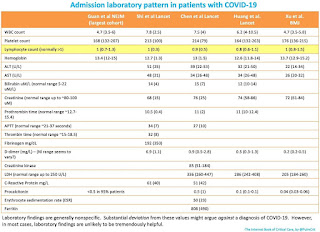
COVID-19に確固とした治療薬がないのが現状である(2020/3/31現在)。CKDにおいて容量調整の点で使用されたものはクロロキン以外はあまりなく、透析に関して言うと分子の大きさ(小さいものほど除去されやすい)、蛋白結合率(蛋白結合率が高いと透析で除去されにくい)、薬物の体内分布(分布が大きければ除去されにくい)を考慮する必要がある。下記の表はその部分をまとめてあるので、参考にしていただきたい。
■透析患者がCOVID-19にかかることでどうなのか?亡くなりやすいのか?
これに関しては読んでて意外であった。
中国の230人の透析患者の報告で、37人がCOVID-19にかかったが、全員ICUに入室するような重篤な症状になることはなかった。37人中27人は無症状で、検査で引っかかった。6人はフォロー中に亡くなったが、これはCOVID-19によるものではなく透析不足による高カリウムや体液過剰などで亡くなっている。透析患者では免疫反応が健常者に比べてしっかりしていないのが原因では?友いわれている。
しかし、別のケースシリーズでCOVID-19で透析患者が2名亡くなったというものがあり、現状では透析患者が亡くなりやすいかは、はっきりした結論はでていない。
■透析患者さんがCOVID-19感染の状況でシャントの障害が生じた場合どうするのか?
シャントの問題としては出血、閉塞、狭窄などが有る。
現在、ほとんどの施設などで手術を減らしたり、止めたりしているところが多い。
シャントは血液透析患者にとっては生命線なので、米国のASDINとVASAのガイドラインでもシャント狭窄の処置は緊急性の高いものとして対応するように推奨している。
今回、情報としては不十分だとは思うが少しでも参考になればと思う。
また、同時に日本・そして世界でこの疾患にさらなる罹患がないように、これを機会にブログの復習をしてもらいたい。
下は透析患者のCOVID-19の際の対応プロトコールになる。参考にしていただきたい。