ぱっとめくったページが腎生理特集で、遠位ネフロンの介在細胞についてだった(CJASN 2015 10 305)。Last authorのDr. Pastor-Solerは私がUPMC(University of Pittsburgh Medical Center)の腎臓内科フェローシップの面接に行ったとき面接官の一人だった。またアイオワ大学腎臓内科のボスであったDr. John Stokesが亡くなって後任を選ぶのに、彼女がアイオワまで面接に来て講演した(そのときも介在細胞の話だった)。
First authorとsecond authorは彼女の部下なのだろう、ヤングスタッフ、あるいはフェロー。アイオワも尿細管(とくに遠位ネフロン)を研究しているから、私も米国に残っていたらこういった総説を書く機会があったのかもしれないなどと思ったりする。が、今となってはこうしてせめて読者としてついていくしかない。これが"C(Clinical)"JASNに載っているということは、臨床家でも専門医ならこれくらいは知っておけということだ…。
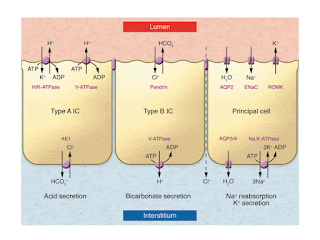
介在細胞は、遠位ネフロン(発生学的には中腎由来の部分)にあって、形態的には簡単に見分けられる。他の尿細管細胞にある中心に一本立った線毛がないからだ(なおこの線毛がどんな機能をしているかはまだ分かっていない、おそらく尿のフローセンサーだろうと推察されるが)。その名の通り、A型介在細胞は酸(acid)を、B型介在細胞は塩基(base)を排泄する。
A型介在細胞は内腔側にH+-ATPase、H+/K+-ATPaseを持ちH+を排泄し、H+と一緒に出来るHCO3-(この反応はCAII: carbonic anhydrase IIによりなされる;B型介在細胞も同じ)は血管側のAE1(anion exchanger 1)に取り込まれる。またA型介在細胞は内腔側に大きなK+チャネル(big KだからBKチャネルという、またはMaxi-Kチャネルともいう)があってカリウム過剰摂取のときなどにK+をflow-dependentに排泄する。
それに対してB型介在細胞はA型介在細胞をひっくり返したようにチャネルが付いていて、内腔側にあるPendrinと呼ばれるCl-/HCO3- exchangerでHCO3-を排泄し、逆にH+-ATPaseが血管側に付いている。
ここまでは、よく知られたことで教科書にも書いてある。臨床的には、H+-ATPaseのa4、B1サブユニットの異常やAE1の遺伝子異常が遠位RTAを起こすことが知られている(以前に
触れた)し、Pendrinの異常はPended症候群を起こす(これも以前に
触れた)。このあと知らないことが次々に出てきた。
まずはB型介在細胞の内腔側にあるNDCBE(Na+-driven chloride/bicarbonate exchanger)だ。B型介在細胞で能動的にH+が血管側に出ると細胞内外に電位差が起こり、NDCBEを通じてNa+が内腔側から細胞内に入ってくる(そして血管側のAE4; anion exchanger 4を使って再吸収される)。同時にHCO3-が細胞内に入りCl-が内腔側に出るが、Pendrinも回るので細胞内に入ったHCO3-は内腔側に再び出て行きCl-が細胞内に再吸収される。
結果、NDCBEが一回周りPendrinが二回周れば、H+-ATPaseによってNaClが再吸収されることになる。いままで遠位ネフロンでのECF再吸収は主細胞の3Na+-2K+-ATPaseによるENaCのみで起こり、残りの現象はENaCによって生じた電位差を利用して説明されてきたので、これは意外だった。
さらに、内腔側と血管側だけでなく介在細胞質内のメカニズムも分かってきた。たとえばA型介在細胞では、H+をたくさん捨てさせる機構としてCAIIでH+と一緒にできるHCO3-を感知するsAC(solubule adenylyl cyclase)活性化→cAMP/PKA活性化→H+-ATPaseの175番アミノ酸残基(Ser)を介したものが発見されている。
逆にH+排泄をdownregulateする機構には[AMP]/[ATP]比の増加→AMPK(AMP-activated protein kinase)活性化→H+-ATPaseの384番アミノ酸残基(Ser)を介したものがある。センサーでいえば、内腔のpHを感知するものとしてGPR4(G protein-coupled receptor 4)、non-receptor tyrosine kinase Pyk2が調べられている。
いわゆるaldosterone paradoxと呼ばれる現象(アルドステロンは高K血症時にはK+排泄をしてNaCl再吸収はしないのに、体液不足時にはNaCl再吸収はするのにK排泄はしない;いまではアンジオテンシンIIとWNK4が関わっていることが分かっているが、これはまた別に書く)にも、介在細胞が関わっている。高K血症でアルドステロンが出るがレニンやアンジオテンシンはない場合、介在細胞のMR(mineralcorticoid receptor)はリン酸化されておりアルドステロンは主細胞にしか作用できない。それでENaC↑→ROMK↑→K+排泄が起こる。
それに対し体液不足でRAASが活性化されている場合、介在細胞内MRのリン酸化が解けてアルドステロンが介在細胞に作用できるようになる。そうすればH+-ATPaseによるNaCl再吸収でENaCまでNa+が届かなかったり、A型介在細胞のH+/K+-ATPaseによりK+が再吸収されたりして、NaClは吸収されてもK+は排泄されない。
他にも介在細胞のH+-ATPaseを修飾するタンパクにはPRR(prorenin receptor)があり、これがreninやproreninをひきつけるのでRAA系の反応効率が上がり、angiotensinogen→angiotensinの変換効率は4倍になる。また介在細胞はPGE2を産生し、paracrineな方法で主細胞のENaCをdownregulateするなどが書かれていた。
そして最後に、これは介在細胞に限ったことではないが、尿細管細胞はTLR(Toll-like receptor)のほぼ全種類を持っていて、とくにTLR4はuropathogenic
E. coliを認識しているといわれ、さまざまなAMP(antimicrobial peptides)を放出して尿を無菌に保とうとすると書かれていた。AMPはdefensin(とくにβ-defensin-2はヘンレ係蹄から集合管まで広く分布している)や、RNAase7(こちらは介在細胞、膀胱上皮、尿道上皮に分布している)、cathelicidin、hepcidinなど100アミノ酸残基以下のペプチドだ。
これらの殺菌物質のほかに静菌物質もあり、A型介在細胞はlipocalin 2を産生する。lipocalin 2と言われてもピンとこないだろうが、これは
NGAL(neutrophil gelatinase-associated lipocalin)のことだ。NGALはAKIでも産生されるが、感染時にも産生されグラム陰性菌の増殖に必要なenterochelinとFe3+の結合体に張り付いて増殖を抑える。さらにNGALはTLRの活性化にも必須とされている。
こんなに長く文献をまとめたのは久しぶりだ。時間があったこともあるが、これを毎日やったら疲弊する。フェロー時代は学びのシャワーを浴びるのが良いからどんどん論文を読んでどんどん吸収していたが、スタッフになったいま、生涯教育として専門性をアップデートするためには、やはり何度も何度もいうように持久力が必要で、そのコツも学んでいかなくてはならない。
[2018年11月追加]本文の最後に介在細胞が抗菌ペプチド(antimicrobial peptide、AMP)を産生して尿路感染症から腎臓を守っていると書いたが、それがインスリン受容体の支配下にあるという論文がJCIにでた(doi.org/10.1172/JCI98595)。糖尿病患者で尿路感染症が多いことと関係あるかもしれない、と著者は言う。