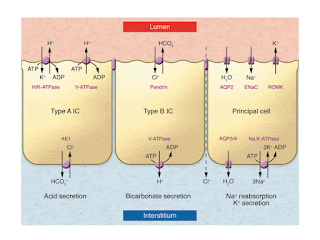
…と言われても、謎と思わない方も多いかもしれない(筆者もそうだった)。遠位尿細管で酸を排泄するA型介在細胞には、内腔側にH+-ATPaseだけでなく、H+を排泄する交換にK+を再吸収するH+/K+-ATPaseもついている(図はJCI 2013 123 4139)。
もしH+/K+ATPaseが異常なら、H+が排泄できずK+が吸収されないはずだ。じっさい、H+/K+ATPaseを阻害するバナジン酸(VO4 3-)を投与すると、低カリウム血症と代謝性アシドーシスになる(Am J Physiol 1992 262 F449)。とても単純な話だ。
しかし問題なのは、遠位RTA患者にH+/K+-ATPase遺伝子の異常が1例も報告されていてないことだ(小児患者で、腸管のH+/K+-ATPase活性が低下していた例はあるが、Arch Dis Child 2001 84 504)。
遠位RTA患者に多いのはH+-ATPaseの遺伝子異常であり、ここから話を始めなくてはならない。そこでATP6V1B1遺伝子(H+-ATPaseのB1サブユニット)欠損マウスをモデルに実験した(JCI 2013 123 4219)ところ、いくつかの驚くべきことがわかった。
まず、A型介在細胞だけでなく、主細胞やB型介在細胞にも変化がみられた。主細胞ではENaC活性が抑制され、B型介在細胞ではPendrin(Cl-再吸収/HCO3-排泄)とNDCBE(Na+・HCO3-再吸収/Cl-排泄、図は図はJCI 2013 123 4139)の活性が抑制されていたのだ。
さらに、主細胞のENaC活性低下は、B型介在細胞が集合管内腔に分泌するPGE2によるパラクラインな機序で説明できることが分かった。PGE2が内腔側から各チャネルの働きを調節していることは以前から知られていたが(こちらも参照)、集合管の細胞どうしの相互作用が、今後いっそう解明されていくと思われる。
それはそうと、低カリウム血症はどうなったか?
同実験ではカリウムチャネルの分布も調べており、そのひとつであるBKチャネルが増加していた。BKチャネルは尿の流れに依存してカリウムを排泄するので、皮質集合管でNa+・Cl-の再吸収が減る(AQP2発現も低下する)ことで尿の流れが増えた結果と考えられる。
さらに、主細胞にあるROMKチャネルは、ENaC活性の減る皮質集合管では増えていなかったが、下流の髄質集合管で増えていた。髄質集合管では(おそらく届くNa+の増加を反映して)ENaCも活性化していたので、その影響と思われる。
なお、遠位RTAのなかでも、アンホテリシンBなど尿細管細胞の傷害による場合は、低カリウム血症の機序もダメージをうけた尿細管からのカリウム喪失(leak)でよいかもしれない。
しかし、アンホテリシンBと同様に低カリウム血症と代謝性アシドーシスをきたすトルエン中毒の場合は、尿細管に漏れやすい傷害は起こらない。この場合の機序は不詳だが、馬尿酸代謝にともなう変化ではないかと言われている。
遠位ネフロン研究は、近位ネフロンにくらべると歴史が古い。それで「もうこれ以上、この部分に効く利尿薬もできないでしょ…」とか、「論文が難解すぎる!」といった気持ちから、着いていくのを諦めそうになることも正直ある。
しかし、学ぶのをやめているうちに、いつかこの分野の研究が想像もつかない(AKI、CKD、腎移植、尿路感染症などすらも越えた)ところにたどり着いているかもしれないから、できるだけついて行きたい(写真は、サウジアラビアで工事再開が待たれる、予定では高さ1008メートルのジッダ・タワー)。