今年になって、SIADの治療のRCTの論文が3つも出ている。どれも、power自体は小さな研究ではあるが、非常に参考になるので少し紹介したい。
2019年に出された、SIADの最新治療と展望はぜひ読んでもらいたい。
本邦のガイドラインでは、治療の手引きでは下記のように記載されている。
次のいずれか(組み合わせも含む)の治療法を選択する。
1:原疾患の治療を行う。
2:1日の総水分摂取量を体重1 kg当り15~20 mlに制限する。
3:食塩を経口的または非経口的に1日200 mEq以上投与する。
4:重症低ナトリウム血症(120 mEq/L以下)で中枢神経系症状を伴うなど速やかな治療を必要とする場合はフロセミドを随時10~20 mg静脈内に投与し、尿中ナトリ ウム排泄量に相当する3%食塩水を投与する。その際、橋中心髄鞘崩壊を防止す るために1日の血清ナトリウム濃度上昇は10 mEq/L以下とする。
5:異所性バゾプレシン産生腫瘍に原因し、既存の治療で効果不十分な場合に限り、 成人にはモザバプタン塩酸塩錠(30 mg)を1日1回1錠食後に経口投与する。投与開 始3日間で有効性が認められた場合に限り、引き続き7日間まで継続投与するこ とができる。
6:デメクロサイクリンを1日600~1,200 mg経口投与する。
SIADに伴うものでも、重症低Na血症であれば治療は3%生理食塩水などの高張食塩水を用いて治療するが、Naが125や130mEq/L程度のSIADに対しての治療はかなり統一されていないと感じる。水制限をして、塩分負荷をする治療を行うが、患者さんによっては塩分負荷がかなり苦痛に感じる人も多い。
では、ここから3本の結果を説明していく。
・まず、タイで行われたRCT(EFFUSE-FLUID Trial)で92人のSIAD患者さん(腎機能はeGFR>60mL/min/1.73m2)に対して、水分制限群(500-1000ml/day未満)、水分制限+フロセミド群(20-40mg/day)、水分制限+塩分負荷(3g/day)+フロセミド群で比較を行っている。
primary outcomeは4、7、14、28日目の血清Naの変化をみている。
ここで、SIADの低Na血症の治療のときにまずは水制限。そして必要があれば追加の治療を検討する。その際にフロセミドや塩分負荷以外の方法はないのか?ということが疑問として出てくる。
追加治療という点でよくトルバプタンを使用することが多くなってきている。しかし、トルバプタンは高価な治療薬であり、また過度に補正されすぎることがある。
そこで、2020年の報告で出てきたものが、エンパグリフロジンのRCTである。
・これは、スイスからの報告であり二重盲検でのRCTで87人のSIAD患者に対して、水分制限(<1000mL/day)に1日1回のエンパグリフロジン群とプラセボ群で4日間投与して比較したものである。primary endpointは4日投与してのNa変化である。
そもそも、SGLT2が用いられている理由は、近位尿細管からのグルコースの再吸収阻害により、尿糖を増加させ、浸透圧利尿により自由水排泄が促されるためである。
そして、飲水制限が治療の前提で話していたけど、本当に飲水制限はいい治療なの?というのがアイルランドからの報告で出ている。
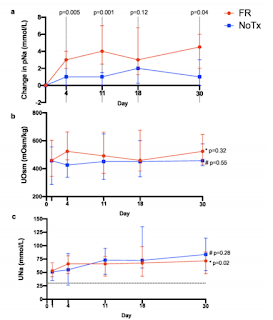
・この報告は非割り付けのRCTでSIAD患者(46人)に対して水制限群(1L/day未満)と水制限をしない群で比較したものである。primary endpointは4日目と30日目の血清Naの変化である。
また、上記の表が、飲水制限群と非制限群の飲水量の違いになる。
この研究から、飲水制限は有用な治療であるが、飲水制限群でも何人かの患者はNa上昇が不十分で飲水制限に追加の治療が必要になっていた。その際の追加治療に関しては、費用・効果などを考えての治療になってくる。今後はSGLT2も一つの選択肢になるかもしれない。
SIADは意外に出会う機会は多い。その中で、最新の知識をupdateしながら管理する必要がある。