酸の摂取量PRAL、産生量NEAP、排泄量NAEなどによって大規模コホートを層別化してCKDの進行やESRDとの相関を示したスタディが最近でてきた。
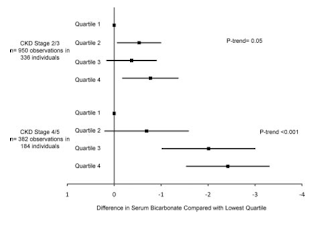
まず2011年、アフリカ系アメリカ人の高血圧性腎症を対象にしたAASKコホートで、Frassettoの式で計算したNEAPと血中HCO3濃度の相関をしらべた論文がでた(CJASN 2011 6 1526)。たんぱくとカリウムの摂取量は24時間蓄尿の尿素窒素とカリウムから推計され、NEAPは平均71mEq/dだった。
結果、NEAPが10mEq/dふえるごとHCO3-濃度が0.16mEq/lさがり、この関係はCKD2・3期よりもCKD4・5期でより顕著にみられた(図)。いままで代謝性アシドーシスでHCO3-を上げるには重曹と考えられてきたが、このスタディでNAEPを減らすのに(とくに動物性)たんぱくを減らし(アルカリのもとであるクエン酸カリウムなどが多い)野菜や果物をとってもいいんじゃないかと示唆された。
つづいて、NHANESIIIコホートでRemer式の酸負荷(PRALとOAの和)とESRDリスクの相関を調べた論文がでた(JASN 2015 26 1693)。RRALは食事内容のアンケートから推計し、OAは体表面積から計算し、酸負荷は平均で42mEq/dだった。結果、酸負荷が多い群ほどESRDリスクが高く(図)、HCO3-やたんぱく摂取量、糖尿病や高血圧、腎機能やアルブミン尿などの交絡因子の影響を除外しても酸負荷が1mEq/d増えるごとESRDリスクが1.39(95%CI 1.19-1.63)倍になった。
うえのふたつは酸負荷(摂取、産生量)からみたスタディで、負荷がおおいと腎臓に悪いから負荷を減らそうという結論が示唆された。それにたいして2015年にヨーロッパのNephroTestコホート(KI 2015 88 137)を対象に酸排泄能に注目した論文がでた。
まずcross-sectional研究をおこない、腎機能が低下した群ほどNAE(尿NH4 + 滴定酸 - HCO3)が下がり酸排泄能がおちているのに対し酸産生NEAP(Frassettoの式)は下がらないのでNAE-NEAPバランスがプラスで酸がたまっていることを示した(図)。
つづいてこのコホートを約4年フォローしてESRDリスク因子について分析したところ、TCO2ではなく24時間尿NH4量(Cr補正)と断食早朝尿NH4濃度(浸透圧補正)に相関がみられた(図)。どうしてNAEではなく尿アンモニアでみたかというと、cross-sectional研究のときに腎機能に比して滴定酸排泄量はあまり変わらず、NAEの低下にもっとも関与するのはアンモニアと考えたからだそうだ。尿HCO3は、もともと微量だ。
このスタディで、
A. 酸負荷がおおいのがいけないのか
B. 酸排泄できないのがいけないのか
という問題がうまれた(図は前出JASN論文の著者Scialla先生によるcommentary;KI 2015 88 9)。
で、この問いに答える形で4月に発表されたのがこのブログでも取り上げられた論文だ(doi: 10.1681/ASN.2016101151)。2011年のCJASN論文とおなじAASKコホートを使い、24時間蓄尿で求めたアンモニア排泄量とさまざまな因子の関係を調べた。これをみると尿アンモニア排泄量とESRD/死亡率の関係はU字で、30mEq/を底辺にそれより低いほどあがるのは2015年KI論文と一緒だけれど、たかくても上がることがわかった(図)。
尿アンモニア能があれば酸をどれだけ摂っても排泄してくれるから大丈夫、というわけではないということだ。そう考えると、前出のA・Bをあわせた
C 酸がたまるのがいけない
ようにも思われる。NAEPとNAEの差や、間質のアンモニアレベルやそれを代理する新たなマーカーを調べた研究が今後あれば、それについて分かるかもしれない。
これらを踏まえて、CKDのアシドーシス診療どうなっていくのだろうか?つづく。
まず2011年、アフリカ系アメリカ人の高血圧性腎症を対象にしたAASKコホートで、Frassettoの式で計算したNEAPと血中HCO3濃度の相関をしらべた論文がでた(CJASN 2011 6 1526)。たんぱくとカリウムの摂取量は24時間蓄尿の尿素窒素とカリウムから推計され、NEAPは平均71mEq/dだった。
結果、NEAPが10mEq/dふえるごとHCO3-濃度が0.16mEq/lさがり、この関係はCKD2・3期よりもCKD4・5期でより顕著にみられた(図)。いままで代謝性アシドーシスでHCO3-を上げるには重曹と考えられてきたが、このスタディでNAEPを減らすのに(とくに動物性)たんぱくを減らし(アルカリのもとであるクエン酸カリウムなどが多い)野菜や果物をとってもいいんじゃないかと示唆された。
つづいて、NHANESIIIコホートでRemer式の酸負荷(PRALとOAの和)とESRDリスクの相関を調べた論文がでた(JASN 2015 26 1693)。RRALは食事内容のアンケートから推計し、OAは体表面積から計算し、酸負荷は平均で42mEq/dだった。結果、酸負荷が多い群ほどESRDリスクが高く(図)、HCO3-やたんぱく摂取量、糖尿病や高血圧、腎機能やアルブミン尿などの交絡因子の影響を除外しても酸負荷が1mEq/d増えるごとESRDリスクが1.39(95%CI 1.19-1.63)倍になった。
うえのふたつは酸負荷(摂取、産生量)からみたスタディで、負荷がおおいと腎臓に悪いから負荷を減らそうという結論が示唆された。それにたいして2015年にヨーロッパのNephroTestコホート(KI 2015 88 137)を対象に酸排泄能に注目した論文がでた。
まずcross-sectional研究をおこない、腎機能が低下した群ほどNAE(尿NH4 + 滴定酸 - HCO3)が下がり酸排泄能がおちているのに対し酸産生NEAP(Frassettoの式)は下がらないのでNAE-NEAPバランスがプラスで酸がたまっていることを示した(図)。
つづいてこのコホートを約4年フォローしてESRDリスク因子について分析したところ、TCO2ではなく24時間尿NH4量(Cr補正)と断食早朝尿NH4濃度(浸透圧補正)に相関がみられた(図)。どうしてNAEではなく尿アンモニアでみたかというと、cross-sectional研究のときに腎機能に比して滴定酸排泄量はあまり変わらず、NAEの低下にもっとも関与するのはアンモニアと考えたからだそうだ。尿HCO3は、もともと微量だ。
A. 酸負荷がおおいのがいけないのか
B. 酸排泄できないのがいけないのか
という問題がうまれた(図は前出JASN論文の著者Scialla先生によるcommentary;KI 2015 88 9)。
で、この問いに答える形で4月に発表されたのがこのブログでも取り上げられた論文だ(doi: 10.1681/ASN.2016101151)。2011年のCJASN論文とおなじAASKコホートを使い、24時間蓄尿で求めたアンモニア排泄量とさまざまな因子の関係を調べた。これをみると尿アンモニア排泄量とESRD/死亡率の関係はU字で、30mEq/を底辺にそれより低いほどあがるのは2015年KI論文と一緒だけれど、たかくても上がることがわかった(図)。
尿アンモニア能があれば酸をどれだけ摂っても排泄してくれるから大丈夫、というわけではないということだ。そう考えると、前出のA・Bをあわせた
C 酸がたまるのがいけない
ようにも思われる。NAEPとNAEの差や、間質のアンモニアレベルやそれを代理する新たなマーカーを調べた研究が今後あれば、それについて分かるかもしれない。
これらを踏まえて、CKDのアシドーシス診療どうなっていくのだろうか?つづく。