今日は腎移植での代謝異常について触れていこうと思う。この代謝異常の管理・認識こそが腎臓内科医が移植医療に介入する意義だと個人的には考える。
代謝異常と言っても様々なものがあるが、①肥満、②副甲状腺機能、③糖尿病に絞ってみていこうと思う。
そして、それぞれの代謝異常を移植前、移植周術期、移植後という違う局面で見てみる。
・移植前
①肥満:肥満があることで腎移植患者にとっては様々な悪影響をもたらす(Cardiol Rev 2019)。心血管疾患、CKD、高脂血漿、うつ病、糖尿病、逆流性食道炎、痛風、肝疾患、結石、悪性腫瘍(乳がん、大腸、胆嚢、腎、肝臓、肺、膵臓など)との関連が言われている。
本邦でも、生体腎移植のドナー条件としてBMI 30以下がドナーガイドラインでは推奨されている(マージナルドナーでは、32以下)。レシピエントに関しては、明確な基準は本邦ではないが、systematic reviewでもBMI 30以下が推奨されている。
移植前は、レシピエント・ドナーともに、まずこの目標に達してもらうためにダイエットをしていただくことになる(肥満手術治療も有用であることが言われている(後述))。
②副甲状腺機能:移植前のPTH増加は加療する必要性がある。これは腎移植後の副甲状腺機能亢進症の重大なリスクになるためである。移植後副甲状腺機能亢進症は移植後の骨粗鬆症やグラフトに対してのリスクとなりうる。移植前に副甲状腺摘出術を行うことは移植後の骨密度の改善に寄与することは示されている(AJT2014)後ろ向き研究で移植前に正常の6倍以上のPTHレベルの場合には移植後の腎臓廃絶と関連することが示されている(Surgery 2017)。
移植前にPTHコントロールが悪い場合には副甲状腺摘出術も含め積極的に考慮することが重要である。
③糖尿病:糖尿病は、心血管リスク増加、生存率低下や移植腎廃絶との関連性が示唆されている(KI rep 2017)。
耐糖能異常者における生体腎移植のドナー条件では糖尿病がないこと(早朝空腹時血糖126mg/dl以下でHbA1c 6.2%以下。迷うときはOGTTを行う)をドナーガイドラインでは推奨している。マージナルドナーとしては経口糖尿病治療薬でHbA1c 6.5%以下で良好に管理されているもの(インスリン治療は適応外)である。
何にせよ生体腎移植前にドナーは糖尿病をもっていないことが望ましい。また、レシピエントも良好なコントロールをすることが必要である。
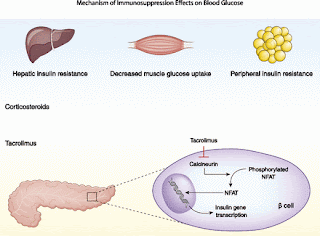
ただ、移植後に糖尿病になることがある(以前のNODATの記事参照、移植後1年で7-30%)。NODATのリスクとしては研究から7個挙げられている(Diabetes care 2011)(年齢、ステロイド治療、高尿酸血症に対する処方、BMI、空腹時血糖、中性脂肪、2型糖尿病の家族歴)。その他の因子としては人種、C型肝炎、シクロスポリンよりタクロリムスを使用している場合が挙げられる(JASN 2006)
・移植周術期
①肥満:これは最近のSystematic reviewでBMI>30で急性拒絶、患者死、graft loss、移植腎機能低下のリスクが高くなることが示されている(Exp Clin Transplant2016)また、創傷治癒低下が肥満患者で40%以上が経験する。意外にもステロイド使用は移植後の体重増加との関連はないとされている(Transplant proc 2014)ただ、肥満であっても移植をしたほうが透析をしているよりも予後は良いことがわかっている。
③糖尿病:観察研究ではあるが、非糖尿病患者であっても術中高血糖が感染・有害事象・再手術・死亡率の上昇に寄与することが示されている(Ann Surg2013)。また、移植後早期の高血糖は感染と拒絶リスクを上げることがしめされている(Transplantation 2001)。
NODATの予防に有効な薬物療法としてはインスリンである(JASN2012)。これは個人的に知らなかったので驚いた。メトホルミンやSU剤などの有効性に比べ、基礎・追加インスリン治療(速攻型と持効型を用いたもの)のほうがβ細胞の保護やさらなるダメージ防止の観点で有効性が高い。
・移植後
①肥満:体重増加は移植後に多く起こるため、肥満は移植後に最も多く直面する代謝異常である(CKJ 2017)。肥満に対しては、体重コントロールのアドバイスよりも肥満手術の方が移植後や末期腎不全の症例に対しても有用性の高さが示されている。これは移植前のBMIのゴールを達成するのにも有用である(Journal of gastric surgery 2019)。肥満は交感神経の活性化・RAA系の変化を起こしうる(Exp Ther Med 2016)。移植後の肥満管理は重要である。
②副甲状腺機能:PTH上昇は血管抵抗の構造的変化や血管拡張障害を起こす(EJE 2017)。
二次性副甲状腺機能亢進症はCKD患者で起こり、移植後で66%の患者で持続する。移植後にPTHが正常化することは骨、移植腎機能や死亡率の点でも重要である(Transplantation 2015)。
PTHは下記に示すように腎臓、骨や消化管でのカルシウム・リンのバランス維持に寄与している。
シナカルセルト(レグパラ)は移植後の副甲状腺機能亢進症に対して最もデータがある。しかし、本邦では純粋な保険適応はないのが現状ではある。副甲状腺摘出術に関しては、ある論文では副甲状腺摘出術を行っても移植腎にとってのメリットは少なく、逆に手術をすることで腎機能が軽度悪化したと報告している。RCTで副甲状腺摘出術とシナカルセルトによる薬物治療を比較したものがJASN 2015にあり、これでは副甲状腺摘出術を行った場合の方がカルシウムやPTH濃度のコントロールが容易であり、骨密度の改善もあったが、長期の有用性に関しては定かではない。
副甲状腺機能亢進症があることは移植後にとって良くない結果をもたらすため、移植前にしっかりと対処しておくことが非常に重要である。移植後の管理に関しては、明確なものがないが、シナカルセルトが使用できる状況であれば使用しての管理が適切なのかもしれない。
③糖尿病:糖尿病は動脈硬化を促進し、動脈の弾性を低下させる(NEJM 2003)。死亡、移植腎機能、急性拒絶反応との関連性が示唆されている(CJASN 2008)。
移植後DM治療でSGLT2阻害薬は心血管系合併症や微小血管合併症の店でも有用な治療の選択肢となりうる。しかし、懸念されるのは使用に伴う尿路感染ではあるが小さな研究にはなるが移植後1年経過した患者49人にでSGLT2阻害薬を使用したところ、1名だけが尿路感染による敗血症で中止している(Diabetes care 2019)。なので、SGLT2阻害薬は移植後1年を経過し腎機能が安定した症例には考慮していい選択肢の可能性がある。
DPP4阻害薬に関しては低血糖リスクを避けつつ糖尿病管理をするというメリットがある。シタグリプチン(ジャヌビア)は腎移植患者の空腹時血統改善効果が示されているが、腎機能に応じての容量調整が必要になる。その点でリナグリプチン(トラゼンタ)は腎機能に応じての容量調整が必要がないという点で有用である。また、GLP-1阻害薬はインスリン抵抗性の改善と体重減少の点で有用な手段である。
免疫抑制剤は移植後高血糖との関連性が示唆されていて、ステロイドとタクロリムスが代表であり容量依存性である。タクロリムスをシクロスポリンに変更することで高血糖を避けることができる可能性はあるが、拒絶リスクが上昇するためここの症例で吟味が必要である。
腎移植の代謝異常は腎臓内科医にとって重要な部分であるし、ここに注目をして管理をしていく必要性がある。
でも、移植って本当に奥が深いし、その分しっかりと基礎的な知識をつけていかなくてはならないなと実感する。